Введение. Уротелиальный рак занимает 4-е место по распространенности злокачественных опухолей после рака простаты, легкого и колоректального рака [1]. Данный вид опухоли может возникать как в нижних (мочевой пузырь или уретра), так и в верхних (чашечно-лоханочная система почки или мочеточник) мочевыводящих путях. Рак мочевого пузыря составляет 90–95% среди всех случаев уротелиального рака. Уротелиальный рак верхних мочевыводящих путей (УРВМП) встречается довольно редко и составляет 5–10% от всех случаев уротелиального рака [1, 2].
Опухоли лоханки почки встречаются в 2 раза чаще, чем опухоли мочеточника. В 8–13% случаев выявляется сочетанный рак мочевого пузыря [3]. Рецидив заболевания в мочевом пузыре встречается у 31–50% пациентов, страдающих УРВМП, в то время как рецидив в лоханке с контрлатеральной стороны встречается только в 2–6%. Уротелиальный рак верхних мочевыводящих путей с вовлечением мышечного слоя стенки характеризуется плохим прогнозом, пятилетняя специфическая выживаемость составляет <50% при рТ2/рТ3 и <10% при рТ4 [4].
Золотым стандартом лечения УРВМП независимо от расположения опухоли (Т1-3N0-1М0) [5] является радикальная нефруретерэктомия с резекцией мочевого пузыря. Однако при low-grade (низкая степень) и low-stage (низшая стадия, низшая ступень) УРВМП при наличии технических возможностей у хирурга и отсутствии противопоказаний можно проводить органосохраняющие операции [6] (Клинические рекомендации. Уротелиальный рак верхних мочевыводящих путей, 2017). В связи с этим особенно актуальным в настоящее время стал поиск новых эффективных методов лечения, одним из которых в последние годы оказалась интерстициальная лазерная коагуляция (ИЛК) [7–9].
Представляем собственное наблюдение пациента О. 59 лет с первичной опухолью правой почки, имплантационными метастазами в мочевой пузырь и гематогенными – в печень.
На момент первичного обращения (ноябрь 2008 г.) пациент О. 1958 года рождения в течение 20 лет страдал мочекаменной болезнью, по поводу чего неоднократно проводились курсы литокинетической терапии и дважды (в 1999 и 2006 гг.) – сеансы дистанционной ударно-волновой литотрипсии камней средней и нижней трети правого мочеточника.
С ноября 2008 г. отмечал появление периодических тянущих болей в поясничной области справа. При обследовании в марте 2009 г., по данным УЗИ, определена незначительная правосторонняя каликопиелоэктазия, в лоханке – гиперэхогенная структура с акустической дорожкой 5 мм, патологических образований справа не было.
При мультиспиральной компьютерной томографии (МСКТ) мочевыделительной системы и забрюшинного пространства с контрастированием в проекции лоханки правой почки определено мягкотканное (33 HU) образование неправильной формы с неровными контурами (диаметром до 21 мм). Образование более четко визуализировалось лишь в выделительную фазу в виде дефекта наполнения лоханки (рис. 1). Также в лоханке правой почки визуализировался конкремент размером 4,9×2,3 мм, плотностью до 300 HU.

Лабораторные показатели: в общем анализе крови Hb – 144 г/л, гематокрит – 40,7, эр. – 4,86 1012/л, ЦП – 0,89, л. – 10,3 109/л, э. – 2%, п. – 1%, с. – 72%, лимф. – 17%, м. – 8%, СОЭ – 39 мм/ч; в общем анализе мочи белок – 0,075, эпителий – 0–1, эритроциты – 5–6, лейкоциты – 5–7, слизь+, бактерии+.
На основании полученных данных больному установлен диагноз «опухоль лоханки правой почки Т1NxMx. Мочекаменная болезнь: камень правой почки. Хронический пиелонефрит, латентное течение».
Больному предложено лечение в объеме нефруретерэктомии справа с резекцией мочевого пузыря, от которого больной категорически отказался.
С учетом установленного диагноза, отсутствия метастатического поражения и категорического отказа больного от радикальной операции 03.04.2009 выполнена ретроградная пиелоскопия, при которой визуализировано ворсинчатое образование лоханки правой почки размером 20×15 мм, камень около 5 мм. Пациенту проведена уретеролитоэкстракция, затем – лазерная резекция новообразования с последующей вапоризацией. При уретерографии констатировали значительное уменьшение размеров дефекта наполнения со свободным поступлением контраста во все группы чашечек. Операция завершена установкой мочеточникового стента 4,7 Шр.
Гистологическое заключение от 05.04.2009: уротелиальный папиллярный рак G1. Послеоперационный период протекал гладко. С рекомендациями пациент выписан под наблюдение онколога.
Спустя 2 мес. пациент обратился повторно с жалобами на незначительные тянущие боли в правой поясничной области. При УЗИ отмечена незначительная каликопиелоэктазия справа.
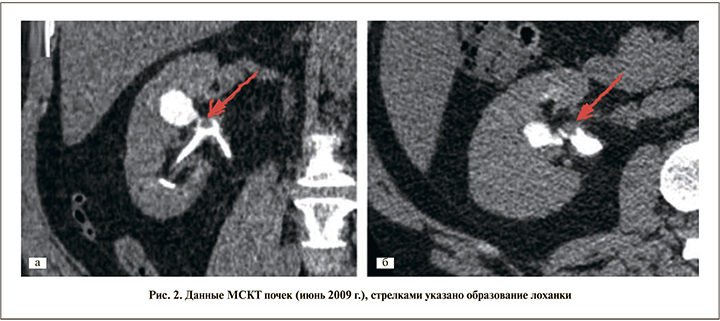
По данным МСКТ от 03.06.2009: по сравнению с исследованием от 24.03.2009 в лоханке правой почки сохранен дополнительный объем мягкотканной плотности (отчетливо выявлен в выделительную фазу в виде «полиповидного» дефекта наполнения): размер его уменьшился до 8×8,5 мм.
Там же определен кальцинат до 4,3 мм и отмечено расширение прилежащей средней чашечки до 18 мм. В артериальную фазу плотность патологической зоны увеличилась с 25 до 45 HU. Признаков распространения опухолевого процесса не выявлено (рис. 2). В лабораторных анализах – незначительная эритроцитурия и протеинурия.
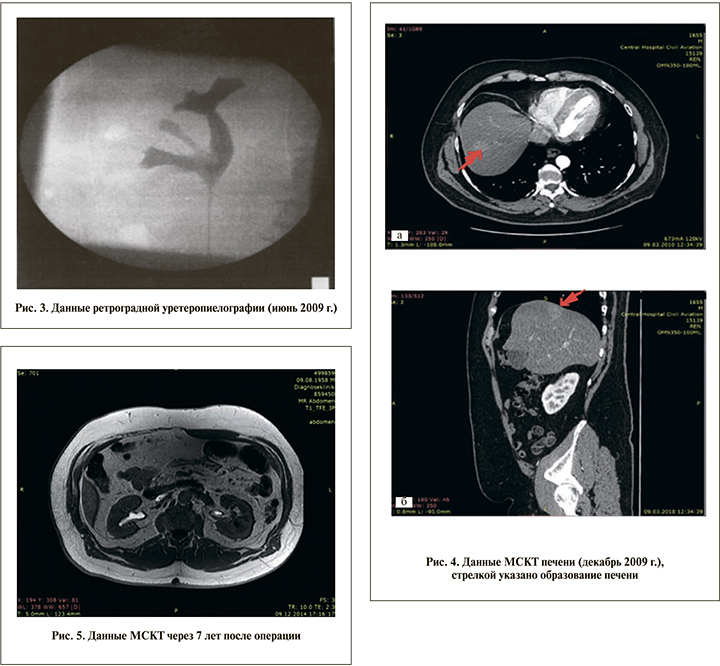
С пациентом повторно проведена беседа о необходимости радикальной нефруретерэктомии, от которой больной повторно категорически отказался. 08.06.2009 пациенту проведена ретроградная уретеропиелография, при которой определялся дефект наполнения лоханки правой почки с замедленным и более слабым контрастированием средней чашечки (рис. 3). При ретроградной пиелоскопии в области шейки средней чашки визуализированы рыхлые некротизированные ткани. Выполнена лазерная резекция с вапоризацией оставшихся тканей в области шейки средней чашечки.
Гистологическое заключение: уротелиальный папиллярный рак G1.
Через 3 мес. (сентябрь 2009 г.) пациенту выполнена плановая контрольная МСКТ с болюсным контрастированием, по данным которой дефекта наполнения не выявлено. При диагностической ретроградной уретеропиелоскопии визуальных изменений в мочеточнике, лоханке и средней чашке правой почки не выявлено.
В ноябре 2009 г. при цистоскопии обнаружены изменения в области треугольника Льето. Проведена биопсия данного участка.
Гистологическое заключение: фрагменты стенки мочевого пузыря с мелким очагом высокодифференцированного погружного уротелиального рака с железистой метаплазией без инвазии G1.
После получения результатов гистологии пациент начал готовиться к плановой госпитализации для лечения, однако спустя несколько дней отметил появление сгустков крови в моче, вскоре после этого развилась острая задержка мочи. Пациент госпитализирован, установлен уретральный катетер, с помощью эвакуатора из мочевого пузыря было отмыто около 800 мл сгустков крови.
16.12.2009 пациенту выполнена ТУР стенки мочевого пузыря с опухолью с лазерной вапоризацией ложа удаленной опухоли и внутрипузырным введением 40 мг митомицина.
Гистологическое заключение от 18.12.2009: фрагменты стенки мочевого пузыря с очагами карциномы in situ покровного уротелия, мелким очагом высокодифференцированного погружного уротелиального рака с железистой метаплазией, без инвазии. Имеются участки изъязвления с гранулематозным воспалением. Мышечный слой интактен.
При контрольном обследовании через 3 мес., по данным УЗИ, МСКТ и диагностической цистоскопии, признаков продолжающегося опухолевого роста получено не было. Тогда же, по данным МСКТ, в VII сегменте печени выявлен участок размером около 2 см, активно накапливающий контрастный препарат (рис. 4).
В августе 2010 г. пациент обратился в Университетскую клинику г. Мюнстера (Германия) Вестфальского Вильгельм-Университета, где ему была выполнена лапаротомия с резекцией VII сегмента печени и холецистэктомия. При контрольном ПЭТ/КТ-обследовании данных за наличие метастазов не получено.
Контрольные обследования в 2011 и 2012 гг. включали ПЭТ (от основания черепа до проксимального отдела бедра) и КТ грудной и брюшной полости с оральным контрастированием кишечника и внутривенным введением йодсодержащего неионического контрастного препарата. По результатам никаких указаний на рецидив опухоли или метастазы не получено.
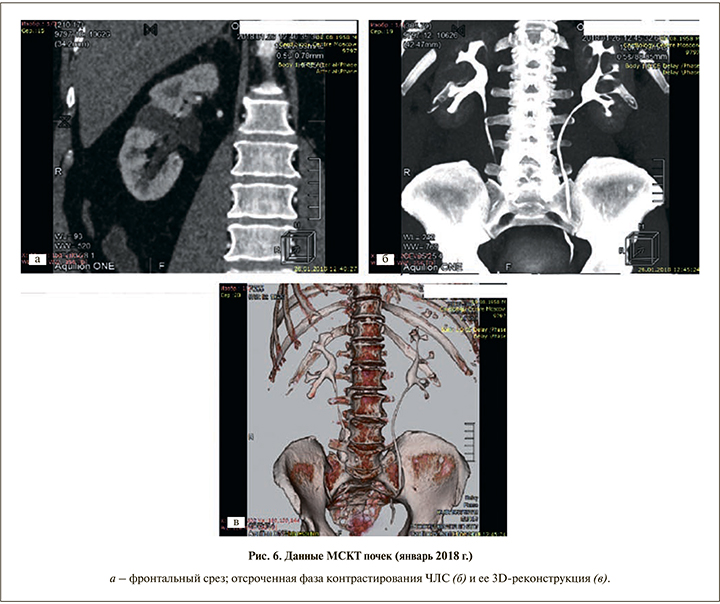
Следующее обследование проведено в 2016 г. и включало УЗИ органов брюшной полости и малого таза, МСКТ органов брюшной полости и мочевыделительной системы (рис. 5), диагностическую цистоскопию и ПЭТ. Признаков опухолевого роста или метастазирования не выявлено.
Последнее обследование, которое пациент прошел в январе 2018 г., включило общеклинические анализы крови и мочи; определение уровня простатспецифического антигена (ПСА); МСКТ органов брюшной полости и мочевыделительной системы. В общем анализе крови: Hb – 172 г/л, гематокрит – 53,3, эр. – 5,96 1012/л, ЦП – 0,89, тр. – 249 109/л, л. – 8,45 109/л, н. – 36,8%, э. – 1,9%, лимф. – 53,6%, м. – 6,9%, СОЭ – 7 мм/ч. В общем анализе мочи: белок отсутствует, эритроциты – 1, лейкоциты – 1, слизь, бактерии отсутствуют, ПСА общего 2,76 нг/мл. Данные МСКТ (26.01.2018): в среднем сегменте правой почки определяется кистозное образование 20х17 мм, которое полностью замещает паренхиму почки. После внутривенного контрастирования накопления контрастного препарата данной структуры не определяется, плотность во все фазы составляет 8–14 HU (рис. 6).
Морфологические и инструментальные исследования позволили оценить объемы изменений в ткани почки, подтвердив безопасность и эффективность лазерного на нее воздействия.
Таким образом, описанное нами клиническое наблюдение свидетельствует о возможности эффективного применения лазерных технологий в лечении уротелиального рака в исключительных случаях и в отсутствие противопоказаний в совокупности с другими методами лечения.



