Введение. Несмотря на то что иммунодепрессанты повышают выживаемость, снижая риск развития отторжения трансплантата, установлено, что они вносят значительный вклад в развитие многих осложнения после трансплантации солидных органов [1, 2]. Инфекционные осложнения составляют 25,4% среди всех причин смерти реципиентов с функционирующим почечным аллотрансплантатом (ПАТ) [3], а также зачастую способны приводить к дисфункции трансплантата.
Пути инфицирования реципиента могут быть различными. К основным источникам инфекции у реципиентов почечного трансплантата относятся латентные очаги, реактивация которых происходит на фоне иммуносупрессивной терапии. Тщательная подготовка пациента к трансплантации, санирование инфекционных очагов способны значительно снизить риск инфекционных осложнений [4].
Достаточно редким в настоящее время, но все еще актуальным является инфицирование реципиента в результате трансплантации инфицированных донорских органов. Это может быть обусловлено как погрешностями изъятия органов, так и недостаточным обследованием реципиента. Донора в обязательном порядке обследуют на бактериальные, грибковые инфекции, а также ВИЧ, гепатиты, сифилис, что позволяет практически исключить риск передачи этих инфекций. Однако риск инфицирования цитомегаловирусной инфекцией (ЦМВ), вирусом Эпштайна–Барр (EБВ) часто недооценивается [5].
 Инфекции, возникающие в результате переноса возбудителей от донора, реактивации латентных инфекций или хирургических осложнений, больше характерны для раннего посттрансплантационного периода. В отдаленном периоде после АТП у реципиентов чаще всего развиваются инфекции в результате инфицирования de novo. Несмотря на то что многие инфекции характерны для общей популяции, риск их клинической манифестации у реципиентов почечного трансплантата значительно выше [6].
Инфекции, возникающие в результате переноса возбудителей от донора, реактивации латентных инфекций или хирургических осложнений, больше характерны для раннего посттрансплантационного периода. В отдаленном периоде после АТП у реципиентов чаще всего развиваются инфекции в результате инфицирования de novo. Несмотря на то что многие инфекции характерны для общей популяции, риск их клинической манифестации у реципиентов почечного трансплантата значительно выше [6].
Перспективным подходом к снижению риска развития инфекционных осложнений служит уменьшение иммуносупрессивной лекарственной нагрузки. На практике это достигается редукцией дозы препаратов (как правило, ингибиторов кальциневрина или глюкокортикоидов) или же полной отменой отдельных компонентов (как правило, глюкокортикоидов). В то же время такой подход не может быть трафаретным. Напротив, требуется индивидуальный подход к предотвращению отторжения трансплантата [7].
В связи с этим необходимы альтернативные подходы к решению данной проблемы. Одним из таких подходов может быть формирование частичной иммунологической толерантности к трансплантату, при которой иммунная система реципиента будет воспринимать чужеродные антигены трансплантата как собственные. Одним из перспективных методов, способствующих формированию частичной иммунологической толерантности, служит фотофорез.
Фотофорез – это метод клеточной иммунотерапии, при котором из крови больного выделяют лейкоциты, сенсибилизируют их 8-метоксипсораленом, затем подвергают длинноволновому ультрафиолетовому облучению и возвращают больному.
Фотофорез впервые был предложен R. Edelson в 1987 г. для терапии Т-клеточной лимфомы кожи [8]. Дальнейшее изучение данного метода показало его высокую эффективность при терапии псориаза, системной склеродермии, купировании реакции «трансплантат против хозяина», ревматоидном артрите и в ряде других заболеваний [9–11]. Фотофорез оказался высокоэффективным в лечении кризов острого и хронического отторжений при трансплантации солидных органов [10]. Эффект от фотофореза характеризуется прежде всего отсутствием тотальной иммуносупрессии, а также ничтожным риском развития каких-либо специфических осложнений. Результаты многоцентровых исследований, посвященных использованию данного метода при трансплантации сердца, легких и стволовых кроветворных клеток, позволили рекомендовать фотофорез в качестве адъювантного метода терапии при развитии отторжения трансплантированных органов [10, 12].

Включение данного метода в стандартный иммуносупрессивный протокол на ранних этапах после трансплантации почки показало хорошие клинические результаты в течение первых 6 мес. наблюдения [13]. В настоящее время работы, посвященные изучению долгосрочных результатов профилактического применения фотофореза и его влияния на развитие инфекционных осложнений после трансплантации почки, отсутствуют, что делает изучение данного вопроса крайне актуальным.
Цель исследования: оценить влияние профилактического применения фотофореза на риск развития инфекционных осложнений в отдаленном периоде после трансплантации почки.
Материалы и методы. Дизайн исследования. Было проведено открытое когортное рандомизированное исследование с включением 60 пациентов с хронической болезнью почек (ХБП) 5Д-стадии. Всем пациентам выполнена одногруппная трупная трансплантация почки. Пациенты были случайным образом рандомизированы в две группы по 30 человек. Все трансплантаты были парные, причем одну почку получал пациент основной группы, другую – группы сравнения. Пациенты основной группы получали стандартную иммуносупрессию и 10–15 сеансов фотофореза в течение первых 6 мес. после трансплантации. Пациенты группы сравнения получали только иммуносупрессивную терапию.
 Пациенты. На момент включения в исследования пациенты не различались по основным клиническим показателям. Среди причин развития ХБП на 1-м месте был хронический гломерулонефрит – по 17 пациентов в группах наблюдения, на 2-м – гипертонический нефросклероз (5 и 2 пациента основной группы и группы сравнения соответственно), на 3-м – поликистоз почек (2 и 4), на 4-м – хронический пиелонефрит (2 и 2), на 5-м – аномалия развития мочевой системы (1 и 3). Для трех пациентов основной группы причиной ХБП послужила диабетическая нефропатия, для двух пациентов группы сравнения – антифосфолипидный синдром. С целью профилактики инфекционных осложнений нефрэктомия собственных почек до АТП выполнена 12 пациентам с частыми рецидивами пиелонефрита в анамнезе. Срок наблюдения за пациентами составил от 1 до 7 лет, в среднем 4,5±2,0 года. Для определения вида и локализации возбудителя инфекции использован комплекс стандартных клинико-лабораторных и инструментальных методов исследований [6]. Верификация виремии осуществлена методом генамплификации. Выделение и идентификация аэробных и анаэробных бактерий проведены при помощи посевов мочи, раневого отделяемого, мокроты на плотные питательные среды.
Пациенты. На момент включения в исследования пациенты не различались по основным клиническим показателям. Среди причин развития ХБП на 1-м месте был хронический гломерулонефрит – по 17 пациентов в группах наблюдения, на 2-м – гипертонический нефросклероз (5 и 2 пациента основной группы и группы сравнения соответственно), на 3-м – поликистоз почек (2 и 4), на 4-м – хронический пиелонефрит (2 и 2), на 5-м – аномалия развития мочевой системы (1 и 3). Для трех пациентов основной группы причиной ХБП послужила диабетическая нефропатия, для двух пациентов группы сравнения – антифосфолипидный синдром. С целью профилактики инфекционных осложнений нефрэктомия собственных почек до АТП выполнена 12 пациентам с частыми рецидивами пиелонефрита в анамнезе. Срок наблюдения за пациентами составил от 1 до 7 лет, в среднем 4,5±2,0 года. Для определения вида и локализации возбудителя инфекции использован комплекс стандартных клинико-лабораторных и инструментальных методов исследований [6]. Верификация виремии осуществлена методом генамплификации. Выделение и идентификация аэробных и анаэробных бактерий проведены при помощи посевов мочи, раневого отделяемого, мокроты на плотные питательные среды.
Иммуносупрессивная терапия. Индукция осуществлена базиликсимабом 20 мг внутривенно до операции и на 4-е сутки после. Метилпреднизолон введен внутривенно капельно во время трансплантации в дозе 10 мг/кг, затем на 1-е и 4-е сутки по 250 мг.
Базовая иммуносупрессия: такролимус в стартовой дозе 0,12 мг на 1 кг массы тела в сутки; поддерживали общепринятые целевые концентрации препарата в крови [1]. Микофенолата мофетил назначен в дозе 2 г в сутки. Стартовая доза преднизолона составила 30 мг в сутки. При стабильной функции трансплантата с 14-го дня дозу преднизолона снижали по 2,5 мг в 3 дня до дозы 20 мг в сут. к концу месяца, далее к концу снижали до поддерживающей дозы 2,5–5 мг.
В случае развития острого отторжения трансплантата проведена пульс-терапия с внутривенным введением метилпреднизолона по 250 мг в течение 4 последовательных суток. При развитии острого гуморального отторжения выполнено 3–5 сеансов каскадной плазмофильтрации и использовали препараты внутривенного иммуноглобулина в дозе 100–150 мг на 1 кг одному пациенту основной группы, в отношении двух пациентов контрольной группы применялся совместно с антитимоцитарным глобулином в дозе 4 мг на 1 кг массы тела.
Процедуры фотофореза начали проводить на 3–7-й день после трансплантации почки и продолжали по следующей схеме: в первые 2 нед. после трансплантации почки по 2 процедуры в неделю, следующие 6 нед. по 1 процедуре в неделю, в течение 3-го месяца – 1 раз в 2 нед., затем 1 раз в месяц в течение 4-го, 5 и 6-го месяца после трансплантации почки. Суммарно получалось 15 процедур фотофореза. Для фотосенсибилизации использовали аммифурин, который рассчитывали в дозе 1 мг на 1 кг массы тела и назначали пациентам за 2–3 ч до начала процедуры заготовки клеток крови. Сепарация и накопление мононуклеарных клеток проведены при помощи аппарата Haemonetics MCS+(США). В течение одной процедуры заготовили около 40–70 мл концентрата мононуклеарных клеток. Затем полученный концентрат клеток ресуспендировали в 200 мл 0,9%-ного раствора хлористого натрия. Клеточную взвесь подвергали ультрафиолетовому воздействию при длине волны 320–400 нм на аппарате Юлия (Россия) в течение 40 мин. Общая доза экспозиции составила 0,8–1,2 Дж/см2. После 90 мин инкубационного периода при температуре 20–24°С клетки реинфузировали пациенту в течение 30 мин.
Методы статистического анализа. Выживаемость оценивалась по методу Kaplan–Meyer. Значимость различий определена с помощью критериев Log rank (отдаленный период) и Breslow (ближайший период).
 При определении относительного риска рассчитаны инцидентность («заболеваемость», отношение количества эпизодов инфекции к суммарному времени наблюдения) в двух группах (отношение количества случаев к суммарному времени наблюдения), а затем их отношение (incidence rate ratio – IRR) и 95% доверительные интервалы (95% ДИ).
При определении относительного риска рассчитаны инцидентность («заболеваемость», отношение количества эпизодов инфекции к суммарному времени наблюдения) в двух группах (отношение количества случаев к суммарному времени наблюдения), а затем их отношение (incidence rate ratio – IRR) и 95% доверительные интервалы (95% ДИ).
Расчеты осуществлены в программах OpenEpiv. 3.01,GraphPadPrizmv.7 и SPSSv.23.
Результаты. У 24 из 30 пациентов основной группы было зарегистрировано 52 эпизода инфекций, у 24 из 30 пациентов группы сравнения – 93. Мы проанализировали встречаемость различных инфекционных осложнений у каждого пациента в двух группах. В группе сравнения количество эпизодов инфекций, приходящихся на одного больного, было приблизительно в 2 раза больше, чем в основной группе: из 24 пациентов группы сравнения у 10 было по 4 и более эпизодов инфекций, в то время как в основной группе такое количество было всего у 2 пациентов.
Мы проанализировали частоту развития любых инфекций в двух группах на разных сроках посттрансплантационного периода (рис. 1).
Риск развития инфекций в обеих группах был непостоянен во времени. Мы выделили три ключевых временных периода. В течение первого месяца после АТП инцидентность в основной группе составила 9,717 (95% ДИ – 6,224; 14,46) на 1 пациенто-год, в группе сравнения – 14,41 (95% ДИ – 9,976; 20,13). Таким образом, риск инфекционных осложнений в течение месяца после АТП в основной группе в целом был сопоставим с риском в группе сравнения – IRR – 0,6761 (95% ДИ – 0,3964; 1,139; р=0,14). В период от 31-го дня до конца первого года инцидентность в основной группе составила 5,682 (95% ДИ – 3,246; 9,227), в группе сравнения – 13,72 (95% ДИ – 9,258; 19,59) на 10 пациенто-лет. Таким образом, риск инфекционных осложнений в основной группе был меньше, чем в группе сравнения: IRR – 0,4139 (95% ДИ – 0,2206; 0,7546; р=0,00369).
В течение третьего периода наблюдения (свыше 1 года после операции) инцидентность в основной группе составила 9,993 (95% ДИ – 5,518; 17,46), в группе сравнения – 37,08 (95% ДИ – 24,83; 53,26) на 100 пациенто-лет. Таким образом, риск инфекционных осложнений в основной группе был значительно меньше, чем в группе сравнения: IRR – 0,2695 (95% ДИ – 0,1327; 0,5211; р<0,0001).
Видно, что риск развития инфекций в обеих группах снижался по мере увеличения срока послеоперационного периода в геометрической прогрессии, однако в основной группе он все-таки ниже, чем в группе сравнения. За весь период наблюдения инцидентность в основной группе составила 4,299 (95% ДИ – 3,21; 5,637), в группе сравнения – 11,06 (95% ДИ – 08,923; 11,06) на 10 пациенто-лет.

В целом риск инфекционных осложнений в основной группе был меньше, чем в группе сравнения: IRR – 0,3888 (95% ДИ – 0,2754; 0,5445; р<0,0001).
По клинической манифестации можно выделить две большие группы инфекционных осложнений: клинически значимые инфекции и бессимптомные. К первой группе мы отнесли респираторные инфекции и пиелонефрит, ко второй – бессимптомные при наличии у пациента бессимптомной бактериурии и вирусной инфекции, подтвержденной репликацией вируса, без клинических симптомов (табл. 1).
Респираторные инфекции мы отметили у 2 пациентов основной группы (суммарно 2 эпизода) и у 6 пациентов группы сравнения (суммарно 9 эпизодов).
При диагностике пневмонии проведено лечение антибиотиками широкого спектра действия, при микробиологической идентификации возбудителя – с учетом его чувствительности к антибиотикам. У одного пациента группы сравнения пневмония развивалась на фоне введения антитимоцитарного глобулина для купирования острого отторжения ПАТ. Также в группе сравнения имел место 1 случай развития туберкулеза на 5-м году после АТП, потребовавший экстренной госпитализации в профильный стационар. В отличие от общей популяции пациентов, реципиенты почечного трансплантата имеют высокий риск молниеносного течения инфекционного процесса. Так, у двух больных группы сравнения развилась пневмония, которая осложнилась острой дыхательной недостаточностью и развитием сердечно-сосудистой недостаточности, что привело к смерти пациентов.
Несмотря на комплексное обследование больных респираторной инфекцией после АТП, выделить основной возбудитель не всегда удается. В нашем исследовании в 2 эпизодах была выявлена Klebsiella pneumoniae, в 1 – Mycoplasma pneumoniae, в 1 – Mycobacterium tuberculosis, в 2 – смешанная флора (микст-пневмония: K. pneumoniae, Acinobacter baumanii).
Острый пиелонефрит ПАТ был диагностирован у 3 пациентов основной группы (3 эпизода) и у 3 пациентов группы сравнения (4 эпизода). Течение острого пиелонефрита в 5 случаях сопровождалось ухудшением функции ПАТ. Во всех случаях исходом терапии было восстановление функции ПАТ до первоначальных значений, регистрируемых до возникновения пиелонерфита.
Бессимптомная бактериурия (ББ) встречается довольно часто у больных после АТП (от 26 до 61% случаев) [6]. Согласно последним клиническим рекомендациям, выявление ББ у пациентов с ПАТ требует назначения антибактериальных препаратов, так как всегда имеется потенциальный риск прогрессирования ББ до клинически значимой инфекции мочевыводящих путей [1, 6]. Также всем реципиентам ПАТ рекомендовано проводить раннюю профилактику инфекции мочевыводящих путей с помощью ежедневного приема ко-тримоксазола в течение первых 6 мес. после АТП [6].
В нашем исследовании ББ отмечена у 18 пациентов основной группы и у 17 – группы сравнения. Как правило, антибактериальную терапию назначали с учетом чувствительности микроорганизма к антибиотикам. Эти инфекции в большинстве случаев имеют тенденцию к частому рецидивированию. В основной группе отмечено 26 эпизодов ББ, в группе сравнения – 47. Клинически значимые ИМП были описаны выше, лечение остальных эпизодов ББ проведено в амбулаторных условиях.
Мы проанализировали основные патогены, выявленные при посеве мочи больных ББ (табл. 2).
Частота выделения микроорганизмов в двух группах была сопоставимой, что косвенно свидетельствует о том, что пациенты обеих групп в одинаковой мере подвержены контаминации вне- и внутрибольничными штаммами инфекций.
Наличие бессимптомной вирусной инфекции подтверждено методом генамплификации (табл. 3).
Как правило, виремия, вызванная ЦМВ, ЭБВ, ВПГ-1, -2, ВВО, у всех пациентов носила транзиторный характер и при назначении противовирусной терапии спонтанно элиминировалась в течение 2 нед.–1 мес. У 2 пациентов основной группы и у 3 – группы сравнения в отдаленном посттрансплантационном периоде произошла реактивация ЦМВ-инфекции, осложнившаяся дисфункцией трансплантата. По результатам морфологического исследования выявлены пограничные изменения с лимфоцитарной инфильтрацией канальцев до 2–4 клеток. Терапия включила внутривенное введение ганцикловира, метилпреднизолона. Еще у 2 больных группы сравнения имела место тяжелая панцитопения, также ассоциированная с ЦМВ, потребовавшая отмены микофеноловой кислоты и введения гранулоцитарно-макрофагального колониестимулирующего фактора роста.
В группе сравнения был эпизод реактивации ВГВ. У этого пациента на момент трансплантации наблюдалась полная клинико-лабораторная ремиссия хронического вирусного гепатита В, но через 5 лет после АТП произошла реактивация вируса. Пациент был направлен в профильный стационар для проведения дополнительных обследований и лечения. Однако на фоне развития фульминантного гепатита пациент умер в связи с развитием острой печеночно-почечной недостаточности на 1698-е сутки после АТП.
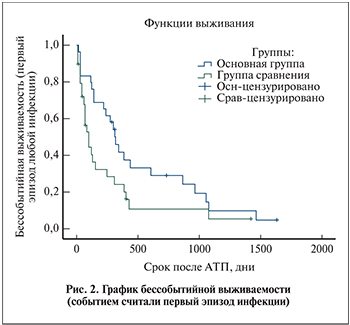
Мы рассчитали бессобытийную выживаемость, где событием считали возникновение первого эпизода инфекции (рис. 2).
Различия в кривых бессобытийной выживаемости были статистически значимы: Log-Rank р=0,013, Breslow р=0,007.
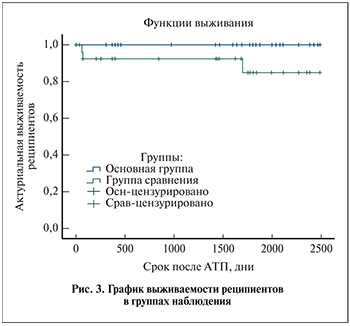
Трое пациентов группы сравнения умерли с функционирующим трансплантатом: двое из них – вследствие тяжелой респираторной инфекции, возникшей через 2–3 мес. после АТП, третий (описан выше) – вследствие развития фульминантной печеночной недостаточности после реактивации ВГВ через 5 лет после АТП. В основной группе смертей не было. Таким образом, 6-летняя выживаемость для основной группы составила 100%, для группы сравнения – 82,8% (95% ДИ – 51,6; 93,16; рис. 3).
Различия в кривых выживаемости реципиетов были статистически не значимы в связи с малым количеством событий: Log Rank р=0,067; Breslow р=0,081.
Обсуждение. Риск развития инфекций во многом детерминирован иммуносупрессивной лекарственной нагрузкой, что неоднократно описывалось многими исследователями. Индивидуализированный подход к назначению и коррекции дозы иммуносупрессивной терапии стал важным элементов по профилактике посттрансплантационных осложнений [14]. В связи с этим снижение риска инфекционных осложнений мы связываем в первую очередь со снижением базисной иммуносупрессии на фоне профилактического применения фотофереза, а также с меньшей потребностью в агрессивной противокризовой терапии.
Ранее мы сообщали, что на фоне проведения фотофореза больным ПАТ удавалось безопасно снижать нулевую концентрацию такролимуса без повышения риска отторжения в последующем наблюдении [15]. Проведение процедур фотофореза в составе стандартного протокола введения больных после АТП не связано с дополнительной иммуносупрессивной нагрузкой, а формирует частичную иммунологическую толерантность [16].
Многие авторы считают, что основная роль в формировании специфической толерантности принадлежит моноцитам и макрофагам, являющим незрелыми дендритными клеткам, которые модифицируются в результате проведения фотофореза [17; 18]. В ГБУЗ МО МОНИКИ им. М. Ф. Владимирского была предложена несколько другая модель формирования толерантности, в основе которой лежит изменение костимулирующего рецептор-лигандного взаимодействия в процессе презентации донорских антигенных пептидов наивным Т-лимфоцитам. Костимуляция Т-лимфоцитов состоит в том, что клетка в дополнение к сигналу, индуцированному через Т-клеточный рецептор, получает второй сигнал, усиливающий пролиферацию и стимулирующий эффекторные функции Т-лимфоцитов.
В костимуляции принимают участие многие молекулы, однако наиболее значимую роль в этом процессе принадлежит взаимодействию B7-CD28/CTLA-4. В ходе иммунологического исследования при использовании фотофореза больными после АТП происходило достоверное снижение плотности экспрессии рецепторов коактивации CD27 и CD28 на наивных Т-лимфоцитах в отличие от контрольной группы, где данная процедура не проводилась. Впоследствии в отсутствие сигнала, генерируемого рецептором CD28, наивные Т-хелперные лимфоциты формируют фенотип с синтезом противовоспалительных цитокинов и дестабилизацией в цитолитических Т-лимфоцитах матричного РНК, с которого транслируется белок, предотвращающий апоптоз. Отсутствие костимуляционного сигнала приводит к наступлению клональной анергии и индукции молекул, ассоциированных с апоптозом [19]. Предполагается, что Т-регуляторные клетки играют ключевую роль в поддержании иммунологической толерантности в отдаленном периоде после трансплантации [20]. Также известно, что фотофорез стимулирует образование Т-регуляторных клеток, что, по мнению ряда авторов, может объяснить толерогеннный эффект фотофореза [21].
Также существуют свидетельства в пользу того, что фотофорез способствует непосредственному снижению риска инфекционных осложнений. Так, Barten et al. [22] включили фотофорез в стандартный протокол иммуносупрессии при трансплантации сердца и обнаружили снижение частоты развития острого отторжения трансплантата, почечной васкулопатии, а также цитомегаловирусной инфекции. Urbani et al. применили фотофорез в отношении реципиентов после трансплантации печени, инфицированных вирусом гепатита, с целью снижения лекарственной иммуносупрессивной нагрузки и повышения эффективности противовирусного лечения комбинацией рибавирина и интерферона. В результате 69% реципиентов успешно завершили курс лечения, а устойчивый вирусологический ответ на лечение был достигнут 50% пациентов [23].
Многочисленные исследования в области механизмов действия и высокой клинической эффективности позволили рекомендовать фотофорез в качестве терапии второй линии в профилактике и лечении трансплантационных отторжений [24].
Заключение. Профилактическое применение фотофереза способствует безопасному снижению базисной иммуносупрессии на фоне формирования частичной иммунологической толерантности, что позволяет значительно снижать риск развития инфекционных осложнений после трансплантации почки.
Работы были выполнены с использованием средств гранта Президента Российской Федерации для государственной поддержки молодых российских ученых № МД-2253.2018.



