Введение. Посттрансплантационное ведение реципиентов почки связано с обязательным и регулярным применением медикаментозной иммуносупрессивной терапии, которая продолжается в течение всего периода функционирования трансплантата. С одной стороны, недостаточная доза иммуносупрессивных препаратов увеличивает риск развития отторжения трансплантата, с другой – ее превышение обусловливает появление инфекционных и онкологических осложнений [1]. Длительный прием некоторых иммуносупрессивных препаратов может сопровождаться такими побочными эффектами, как артериальная гипертензия, сахарный диабет, лейкопения, тромбоцитопения, нейротоксичность и т.д. [1, 2]. В частности, ингибиторы кальциневрина, применяемые 94,4% реципиентов почки [3], сами по себе нефротоксичны и постепенно приводят к развитию поздней дисфункции трансплантата [4]. Несмотря на совершенствование фармакологической иммуносупрессии, отторжение трансплантата по-прежнему служит ведущей причиной дисфункции трансплантата в отдаленном периоде, составляя 37,8% всех случаев его дисфункции по данным морфологических исследований почечных биоптатов [5]. Данный факт диктует необходимость поиска новых подходов к решению проблем лечения и профилактики отторжения почечного трансплантата.
Одним из перспективных направлений в современной трансплантологии является разработка методов индукции иммунологической толерантности к донорским антигенам трансплантата, при которой стало бы возможным проведение редукции или полной отмены медикаментозной иммуносупрессивной терапии [6]. Впервые клиническая эффективность экстракорпоральной фотохимиотерапии (ЭФХТ) в коррекции острого клеточного отторжения была продемонстрирована в 1992 г.: купировать стероидрезистентную форму отторжения удалось у 8 из 9 реципиентов сердечного трансплантата, при этом наблюдение в течение 6 мес. не выявило повторных эпизодов [7]. Последующие многоцентровые исследования позволили получить одобрение Food and Drug Administration (США) для включения данной процедуры в рекомендации по терапии и профилактике отторжения трансплантата сердца, легких, гемопоэтических стволовых кроветворных клеток и печени [8]. Эффективность ЭФХТ связывают с формированием феномена иммунологической толерантности, хотя остаются нерешенными вопросы механизмов его инициации и поддержания [8–10].
В 2010 г. в отделе трансплантологии ГБУЗ МО МОНИКИ им. М. Ф. Владимирского был внедрен метод ЭФХТ для профилактики отторжения почечного трансплантата, который применялся в течение первых 6 мес. после трансплантации [11]. Результаты раннего и позднего посттрансплантационных периодов продемонстрировали высокую клиническую эффективность ЭФХТ в обеспечении лучшей почечной функции трансплантата, снижения рисков отторжения и утраты почечных трансплантатов [12], а также в снижении частоты инфекционных осложнений [13]. Было отмечено, что на 30-е сутки после ЭФХТ происходит снижение плотности экспрессии рецепторов коактивации CD28 на наивных CD4+-Т-лимфоцитах по сравнению с пациентами контрольной группы, у которых данный метод не использовался. Таким образом, наивные CD4+-Т-лимфоциты приобретают «толерогенный» иммунофенотип: CD3+CD4+CD45RO–CD28- [14]. Можно предположить, что взаимодействие данной субпопуляции Т-лимфоцитов с «профессиональными» антигенпрезентирующими клетками (АПК), в частности дендритными клетками, несущими информацию о донорском антигене, приводит сначала к Т-клеточной анергии, т.е. к неспособности в последующем отвечать на сигналы, поставляемые через Т-клеточный рецептор, а впоследствии и к ингибированию полноценного иммунного ответа через второй коактивационный путь между молекулами B-7 на АПК и CTLA-4 на Т-лимфоцитах [15].
Наличие видимого клинического эффекта, выраженного в значительном снижении частоты отторжения трансплантата почки в отдаленном периоде, послужило основанием углубленного изучения иммунологической реактивности реципиентов, включая механизмы иммунологической толерантности.
Цель исследования: оценить влияние профилактического применения метода ЭФХТ на состояние факторов клеточного адаптивного иммунитета, способствующих развитию толерантности, у пациентов в отдаленном периоде после трансплантации почки.
Материалы и методы. В проспективное рандоминизированное когортное исследование вошли 24 пациента после одногруппной трупной трансплантации почки. В основную группу вошли 8 мужчин и 7 женщин в возрасте 45,9±10,5 лет, в группу сравнения – 5 мужчин и 4 женщины в возрасте 49,5±12,9 года. Дополнением к стандартному протоколу иммуносупрессивной терапии пациентов основной группы начиная с 7-го дня и в течение первых 6 мес. после трансплантации почки служили 10 процедур ЭФХТ. При ведении пациентов группы сравнения придерживались только стандартного протокола лечения [1]. Группы статистически значимо не различались по основным показателям: полу, возрасту, продолжительности нахождения на диализе, характеристикам трансплантатов, индексу совместимости и причинам развития терминальной стадии хронической почечной недостаточности собственных почек реципиентов.
Стандартный трехкомпонентный протокол иммуносупрессивной терапии включил такролимус, микофенолат мофетила и преднизолон. Дозы приема микофенолата мофетила и преднизолона в обеих группах были одинаковыми, однако уровень целевой концентрации такролимуса для пациентов основной группы составил 6,64±0,89 нг/мл, для пациентов группы сравнения – 8,14+0,96 (р=0,004).
Иммунологические исследования в группах наблюдения проводили через 4, 30 сут. и 3 года после трансплантации почки при условии отсутствия инфекционных осложнений, клинических и морфологических признаков отторжения.
Протокол исследования был одобрен независимым этическим комитетом при ГБУЗ МО МОНИКИ им. М. Ф. Владимирского. Все пациенты дали добровольное информированное согласие на участие в исследовании.
Иммунофенотипирование лимфоцитов периферической крови (ПК) проводили в научно-исследовательской лаборатории ГБУЗ МО МОНИКИ им. М. Ф. Владимирского на двухлазерном проточном цитофлюориметре FACSCalibur («Becton Dickinson», США) с использованием программного обеспечения CellQwest и моноклональных антител к дифференцировочным антигенам лимфоцитов (BD «Biosciences», США). Оценивали число клеток, экспрессирующих антигены CD3, CD4, CD8, CD19, CD16 и CD56, экспрессию активационных и костимулирующих молекул CD25, CD28 на Т-лимфоцитах, количество Т-регуляторных клеток с фенотипом CD3+CD4+CD25+(hi)CD127-. Выделение региона лимфоцитов проводили по экспрессии панлейкоцитарного антигена CD45 против канала бокового светорассеивания SSC. Популяционный и субпопуляционный составы лимфоцитов оценивали в процентах от гейта всех лимфоцитов, содержание субпопуляции Т-регуляторных клеток рассчитывали в процентах от субпопуляции Т-хелперных лимфоцитов (CD3+CD4+). Интенсивность экспрессии антигенов оценивали по параметру средней интенсивности флюоресценции – Mean Fluorescence Intensity (MFI), выраженной в условных единицах (усл. ед.).
В качестве референсных значений были использованы результаты 18 практически здоровых лиц – доноров крови, обследованных по аналогичным показателям.
Для статистического анализа двух независимых выборок, имевших нормальное распределение, применяли непарный критерий Стьюдента с учетом равенства дисперсий. Проверку соответствия распределения выборок нормальному проводили при помощи критерия Шапиро–Уилка. Данные представлены как среднее±стандартное отклонение (M±SD). Статистическую обработку результатов проводили в программе SPSSv.23, GraphPad Prizm 8.
Результаты. На первом этапе исследования были проведены сравнительная оценка содержания субпопуляции Т-хелперных лимфоцитов ПК, экспрессирующих корецепторную молекулу CD28 (CD3+CD4+CD45RO–CD28+), у реципиентов в раннем и отдаленном посттрансплантационных периодах наблюдения (рис. 1), а также сравнение плотности экспрессии молекулы CD28 на данной субпопуляции клеток по параметру MFI (рис. 2).

Анализ данных показателей, полученных на 3-м году наблюдения за пациентами после трансплантации, не выявил статистически значимых различий как между исследуемыми группами, так и с группой практически здоровых лиц (p>0,05).
Затем было выполнено сравнительное изучение основных параметров адаптивного клеточного иммунитета (табл. 1).
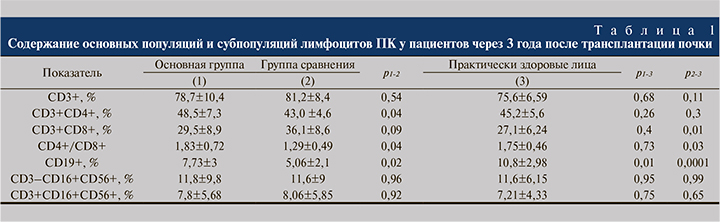
Не выявлено статистически значимых различий (p>0,05) по относительным показателям общих Т-лимфоцитов (CD3+), популяции естественных клеток-киллеров (NK; CD3–СD16+CD56+) и минорной субпопуляции NK Т-лимфоцитов (CD3+СD16+CD56+) ПК у пациентов обеих групп по сравнению с показателями практически здоровых лиц и между собой.
Относительное содержание Т-хелперной субпопуляции лимфоцитов (CD3+CD4+) оказалось статистически значимо выше у пациентов после ЭФХТ, чем в группе сравнения (р=0,04). При сравнении данного показателя обеих групп с таковыми практически здоровых лиц статистически значимых различий не получено.
Выявлено статистически значимое увеличение содержания субпопуляции эффекторных цитотоксических Т-лимфоцитов (CD3+CD8+) (р=0,01) и, соответственно, снижение иммунорегуляторного индекса (CD4+/CD8+) в группе пациентов, не получавших ЭФХТ, по сравнению с практически здоровыми лицами (р=0,03), в то время как в основной группе пациентов данные показатели статистически значимо не отличались от нормальных значений.
Стоит отметить, что уровень В-лимфоцитов ПК (CD19+) был снижен в обеих группах пациентов по сравнению с практически здоровыми лицами (р=0,01), но в группе пациентов, не получавших ЭФХТ, это снижение было особенно выраженным (p=0,0001) и статистически значимым (р=0,02) даже по сравнению с пациентами основной группы.
На рис. 3 представлены данные по количественному анализу Т-регуляторных клеток периферической крови с фенотипом CD3+CD4+CD25+(hi)CD127-.
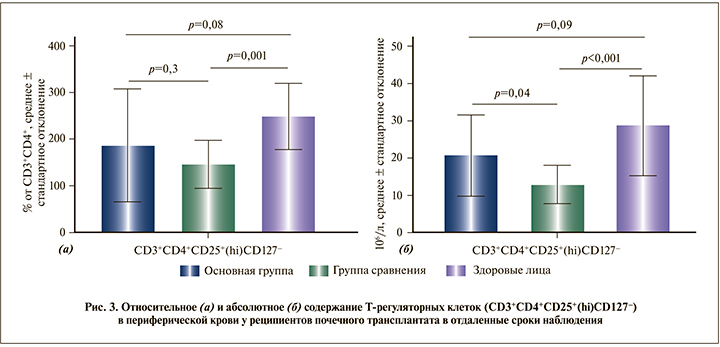
Выявлено, что абсолютное число Т-регуляторных клеток было статистически значимо больше в основной группе, 20,6±10,76•106/л, чем в группе сравнения, – 12,9±4,97•106/л (p=0,04), но несколько ниже, чем в группе здоровых лиц 28,7±13,3•106/л (p=0,09). В группе сравнения содержание Т-регуляторных клеток были значительно ниже показателей здоровых лиц как по абсолютным (p<0,001), так и по относительным (p=0,001) показателям.
Обсуждение. Результаты исследования показали, что профилактическое применение ЭФХТ в раннем посттрансплантационном периоде способствует снижению числа наивных CD3+CD4+CD45RO–CD28+-Т-лимфоцитов, а также плотности экспрессии корецепторных молекул CD28, что обусловливает ингибирование полноценного иммунного ответа [11]. Известно, что антагонистом костимулирующего рецептора CD28 служат молекулы CTLA-4 на CD3+CD4+-Т-лимфоцитах, которые имеют большую степень авидности к молекулам B-7 на АПК [16]. В то же время показано, что ЭФХТ способствует увеличению экспрессии CTLA-4 [17]. Участие молекулы CD28 в презентации антигена сокращает число взаимодействий Т-клеточного рецептора (МНС-пептид), необходимое для формирования активационного сигнала. В отсутствие костимуляции передача сигнала через рецептор не только не приводит к активации Т-клеток, но и вызывает противоположный эффект – клеточную анергию, т.е. неспособность Т-клеток и в последующем отвечать на сигналы, поставляемые через Т-клеточный рецептор. Взаимодействие CD28 с CD80/86 служит сигналом к экспрессии другого лиганда, CD80/86 с CTLA-4. Т-хелперы экспрессируют CTLA-4 вскоре после начала костимуляции. Молекулы CTLA-4 и CD28 гомологичны, но CTLA-4 обладает в 1000–2500 раз более высоким сродством к CD80/86. Главная особенность связывания CTLA-4 состоит в том, что он поставляет ингибирующий сигнал. Учитывая более высокое сродство CTLA-4, чем CD28 к CD80/86, очевидно, что функция CTLA-4 состоит в завершении цепи активационных событий [15]. Таким образом, можно предположить, что ЭФХТ способствует запуску иммунологической толерантности через взаимодействие рецепторов второго коактивационного пути (молекул B-7, расположенных на АПК, с молекулами CTLA-4, присутствующими на Т-лимфоцитах). В процессе такого взаимодействия формируется клон Т-лимфоцитов, направленных на индукцию толерантности к донорским антигенам. Результаты анализа особенностей экспрессии молекулы CD28 на CD3+CD4+-Т-лимфоцитах ПК в отдаленном периоде после трансплантации не показали значимых различий как между исследуемыми группами пациентов, так и с группой практически здоровых лиц, что может свидетельствовать о том, что феномен толерантности в данном случае может поддерживаться за счет действия других иммунорегуляторных механизмов.
Исследование параметров адаптивного клеточного иммунитета в отдаленном периоде у пациентов основной группы продемонстрировало значительно более высокое содержание и более высокие темпы нормализации уровня Т-хелперной субпопуляции лимфоцитов (CD3+CD4+), субпопуляции эффекторных цитотоксических Т-лимфоцитов (CD3+CD8+), а также иммунорегуляторного индекса (CD4+/CD8+) по сравнению с группой пациентов, у которых ЭФХТ с профилактической целью не применялась. Напротив, в группе сравнения сохранялось значительное увеличение содержания субпопуляции эффекторных цитотоксических Т-лимфоцитов и снижение иммунорегуляторного индекса по сравнению с нормальными показателями.
В обеих группах пациентов выявлено существенное снижение содержания В-лимфоцитов ПК (CD19+) по сравнению с нормальными значениями, но в группе пациентов без ЭФХТ это снижение было более резко выраженным. В-лимфоциты являются основными клетками-антителопродуцентами, и существенное снижение числа В-лимфоцитов может приводить к дефициту сывороточных иммуноглобулинов, к развитию инфекционных осложнений.
Описанные выше особенности иммунологической реактивности пациентов основной группы могут быть связаны с эффектом предшествовавшего действия ЭФХТ и формированием толерогенных клонов из клеточных субпопуляций CD4+-Т-лимфоцитов. С другой стороны, эти изменения могут быть объяснены большим угнетением клеточного звена иммунной системы пациентов группы сравнения в связи с более высокой дозой базового компонента иммуносупрессии – такролимуса, хотя его уровень соответствовал значениям стандартного протокола иммуносупрессии [1].
Известно, что из всей популяции CD4+-лимфоцитов Т-регуляторные клетки играют ведущую роль в поддержании периферической толерантности к алло- и аутоантигенам [18]. При анализе содержания Т-регуляторных клеток (CD3+CD4+CD25+(hi)CD127-) нами обнаружено, что их абсолютное содержание в основной группе было на 59% больше, чем в группе сравнения (p=0,04). Эти факты могут свидетельствовать о том, что в основной группе толерантность иммунной системы к трансплантату может поддерживаться за счет иммунологического контроля со стороны Т-регуляторных клеток, обладающих супрессирующим действием в отношении аллогенного клона Т-лимфоцитов. Аналогичные данные по увеличению абсолютных показателей содержания Т-регуляторных клеток после проведения сеансов ЭФХТ были получены при купировании острого клеточного отторжения трансплантата легких и гемопоэтических стволовых кроветворных клеток [19, 20]. Уровень CD3+CD4+CD25+(hi)CD127 Т-лимфоцитов в основной группе был сравним с показателями группы практически здоровых лиц (p=0,09). В группе сравнения уровень этих клеток был значительно ниже, чем в группе практически здоровых лиц (p<0,001). В целом снижение Т-регуляторных клеток у больных с почечным аллотрансплантатом может быть обусловлено несколькими причинами: применением фармакологической иммуносупрессии, в частности ингибиторов кальциневрина [21]; миграцией в лимфатические ткани или ткани трансплантата, что снижает их число в ПК [22].
Концепция о ведущей роли числа Т-регуляторных клеток при развитии феномена иммунологической толерантности при трансплантации почки в настоящий момент главенствующая у ряда исследователей [23].
Заключение. Адьювантное назначение ЭФХТ с профилактической целью в раннем посттрансплантационном периоде способствует инициации иммунологической толерантности через механизм взаимодействия молекул рецепторов второго коактивационного пути B-7 и CTLA-4. В результате формируется толерогенный клон Т-лимфоцитов, который в дальнейшем дифференцируется в соответствующий клон Т-регуляторных клеток. Такая комбинированная иммунотерапия способствует более быстрому восстановлению основных параметров адаптивного клеточного иммунитета в отдаленном периоде (нормализации содержания Т-хелперной субпопуляции, субпопуляции эффекторных цитотоксических Т-лимфоцитов, их соотношения), чего не было достигнуто в отношении пациентов группы сравнения. Существенное снижение содержания В-лимфоцитов ПК сохранялось в течение трех лет наблюдения в обеих группах пациентов, но при применении ЭФХТ это снижение не было резко выраженным, что проявилось в отсутствии инфекционных осложнений.
Отсутствие признаков отторжения у пациентов основной группы по данным протокольных биопсий, а также стабильность показателей почечного трансплантата в совокупности с данными иммунологических исследований позволили произвести снижение целевой концентрации такролимуса на 20% ниже рекомендованной у 13 из 30 пациентов группы с ЭФХТ без развития признаков отторжения в ходе дальнейшего наблюдения [24].



