Введение. Хронический простатит (ХП) – одно из наиболее распространенных, полиэтиологичных, трудных для диагностики и лечения заболеваний в урологической практике. Встречается он у мужчин различных возрастов и этнических групп, наиболее часто у мужчин до 50 лет, и является третьим по частоте урологическим диагнозом у мужчин старше 50 лет (после аденомы и рака предстательной железы [ПЖ]) [1, 2]. Высокая социальная значимость заболевания обусловлена молодым возрастом популяции, негативным влиянием на репродуктивную функцию и психоэмоциональную сферу при значительном снижении качества жизни у мужчин [3]. Однако комплексное изучение течения воспалительных заболеваний ПЖ проводится крайне редко [4].
Комменсальная микрофлора имеет значение в регуляции локального иммунного гомеостаза биотопа [5]. В настоящее время изучаются иммунные механизмы воспаления в ПЖ [1, 6]. Также отмечена важная роль местного иммунного статуса в патогенезе ХП [1]. Показано, что при хроническом бактериальном простатите (ХБП) отмечается повышение концентрации ИЛ-2, ИФ-γ и снижение уровня РАИЛ (рецепторный антагонист интерлейкина). Обнаружено, что при хроническом бактериальном простатите имело место существенное повышение уровней ФНО, ИЛ-1β, ИЛ-6, -8, -18 и снижение концентраций ИЛ-4 и -10.
Не остался без внимания и микробный пейзаж семенной жидкости мужчин, в частности, при формировании цитокинового микроокружения, что определяет связь патологии с цитокин-опосредованными механизмами, запускающими каскад иммунологических реакций. Описана иммунорегуляторная связь как непосредственно микробных клеток, так и их экзометаболитов [7, 8]. Однако имеющиеся сведения об иммуномодулирующем действии симбиотических бактерий не позволяют в полной мере описать вклад микроорганизмов в формирование локального иммунного гомеостаза в зависимости от микроэкологического состояния урогенитального тракта и их влияния на локальный цитокиновый профиль хозяина.
Цель исследования: изучить особенности спермограммы, микробиоты и цитокинового профиля у мужчин с ХБП и ХБП, осложненным бесплодием.
Материалы и методы. Дизайн исследования: проведено ретроспективное сравнительное рандомизированное исследование, включившее 2 группы мужчин репродуктивного возраста (20–45 лет), больных хроническим бактериальным простатитом (ХБП), осложненным бесплодием. Контрольную группу (КГ) составили 30 мужчин, не имевших в анамнезе и в момент обследования клинико-лабораторных признаков ХБП и бесплодия, – группа условно здоровых лиц.
В группу сравнения вошли 1-я группа, включившая 30 пациентов с ХБП, у которых при исследовании эякулята не было выявлено изменений в спермограмме, и 2-я группа – пациенты с ХБП, осложненным бесплодием, у которых выявлены нарушения в спермограмме (n=42).
Пациенты с инфекциями, передаваемыми половым путем, были исключены из исследования.
Алгоритм обследования пациентов включал сбор анамнеза, оценку жалоб, физикальные методы, в том числе трансректальное УЗИ и пальцевое ректальное исследование ПЖ. Также проводили анкетирование с помощью шкалы оценки симптомов ХП Национального института здоровья США (NIH-CPSI) и Международного индекса эректильной функции (IIEF-5).
Критерии постановки диагноза ХБП и включения пациентов в исследование:
1. Клинические признаки (один или несколько):
- боли различной локализации (промежность, над лоном, в яичках, крестце, паховой области и т.д.);
- расстройство мочеиспускания (учащенное мочеиспускание, вялая или прерывистая струя мочи, чувство неполного опорожнения мочевого пузыря, боль во время мочеиспускания);
- нарушения эякуляции (преждевременная эякуляция, боли при и после эякуляции, гемоспермия).
2. Увеличение количества лейкоцитов в секрете ПЖ (более 10–15 в поле зрения) или в моче, полученной после массажа ПЖ.
3. Культуральное подтверждение возбудителя ХП.
3. Длительность заболевания не менее 1 года.
4. Возраст – 20 – 45 лет.
При обследовании пациентов соблюдены акты Национального стандарта РФ ГОСТР 52379-2005 о надлежащей клинической практике.
Всего из спермоплазмы путем посева эякулята на селективные питательные среды было выделено 177 штаммов микроорганизмов. Уровень бактериальной обсемененности оценивали методом секторальных посевов по Gould. Для облигатно-анаэробных бактерий дополнительно создавали анаэробные условия с помощью СО2-инкубатора («Binder», Германия): содержание кислорода от 0,2 до 0,6%, углекислого газа от 5 до 9%. Для посева эякулята использовали плотные питательные среды: Эндо, кровяной агар, Schaedler агар, B.I.G.G.I. Всего было выделено 177 штаммов бактерий: 43 культуры от условно-здоровых лиц, 57 – от пациентов с ХБП и 77 – от больных ХБП, осложненной бесплодием.
Предварительную идентификацию микроорганизма проводили по биохимическим признакам с использованием коммерческих тест-систем («Lachema», Чехия). Окончательную верификацию вида бактерий осуществляли по 16S РНК при помощи секвенатора MiSeq с комплектом реагентов Reagent Kit v.3 («Illumina», США) совместно с сотрудниками Центра коллективного пользования «Персистенция микроорганизмов» ИКВС УрО РАН. При подготовке ДНК-библиотек для секвенирования использовали набор Quick-16S NGS Library Prep («Zymo Research», США), согласно прилагаемому протоколу.
Для оценки биологических свойств микробиоты определяли биопленкообразование (БПО) и антипептидную активность (АПА) в отношении цитокинов ИЛ-10, -1РА, ФНО-α, ИФ-γ и ИЛ-17. Образование биопленок оценивали по способности микроорганизмов к адгезии на поверхности 96-луночного полистиролового стерильного планшета [9].
Изучение способности супернатантов микроорганизмов изменять концентрацию цитокинов проводили путем соинкубирования экзометаболитов микроорганизмов с рекомбинантными цитокинами (ИФ-γ – I3265-1MG, ФНО-α – T6674-10UG, ИЛ-17 – SRP3080, ИЛ-1РА – SRP3084, ИЛ-10 – I9276-5UG) («Sigma-Aldrich,» США) в соотношении 1:1 (опытные пробы). В качестве контроля использовали раствор цитокинов, внесенный в бульон Schaedler (BBL, США). Опытные и контрольные пробы инкубировали в течение 2 ч (37°С), реакцию останавливали на холоде, центрифугировали при 3000 об/мин в течение 15 мин (4°С) и отбирали супернатант. Концентрацию цитокинов в опытных и контрольных пробах определяли иммуноферментным анализом с использованием реагентов «Цитокин» (Россия), учет результатов проводили на фотометре Multiskan Labsystems (Финляндия) при длине волны 492 нм. Антипептидную активность выражали в пг инактивированных цитокинов на 1 мл супернатанта в опыте по сравнению с контролем (пг/мл).
Анализ иммунологических показателей спермоплазмы проведен по 13 параметрам: ФНО-α, ИФ-γ, ИЛ-1РА, -1, -2, -4, -6, -8, -10, -17, иммуноглобулину А (Ig A), лактоферрину и лизоциму. Локальный уровень цитокинов, антимикробных белков из эякулята пациентов, у которых были выделены микроорганизмы, оценивали методом иммуноферментного анализа с использованием наборов «Цитокин» и «Вектор-Бест» (Россия). Результаты регистрировали на фотометре Multiskan Labsystems (Финляндия) при длине волны 492 нм. Уровень лизоцима определяли турбидиметрическим методом [10].
Исследование эякулята проводили по стандарту ВОЗ. Для исключения ошибок в случае выявления патоспермии при первичном обследовании через 2 нед. проводили повторное исследование. Определяли общий объем эякулята, цвет, рН, время разжижения спермы, общее количество сперматозоидов в 1 мл эякулята, их подвижность. Выделяли прогрессивно-подвижные, непрогрессивно-подвижные и неподвижные сперматозоиды. Определяли морфологию, агглютинацию сперматозоидов, клетки сперматогенеза, количество лейкоцитов, эритроцитов, слизь, лецитиновые зерна.
Статистическую обработку полученных данных проводили с использованием пакета Statistica 10 (StatSoft, USA) с оценкой различий между средними величинами по t-критерию Стьюдента. Различия считали статистически значимыми при р<0,05.
Результаты. Оценка параметров спермограммы всех обследованных показала, что цвет и pH эякулята соответствовали норме. У большинства (80,5%) больных ХБП, осложненным бесплодием, отмечено увеличение вязкости эякулята и высокое содержание в нем слизи (у 90,3%). У 83,3% пациентов с ХБП имела место лейкоцитоспермия (7х106), у пациентов с ХБП, осложненным бесплодием, выраженность лейкоцитоспермии была несколько ниже (4х106), у здоровых мужчин количество спермальных лейкоцитов не превышало 106. Снижение доли прогрессивно-подвижных сперматозоидов (23,0±2,5%) на фоне увеличения числа сперматозоидов с непрогрессивным движением (28,0±1,1%) и неподвижных (49,0±3,0%) отмечено у пациентов 3-й группы. Статистически значимого снижения концентрации сперматозоидов в 1 мл у больных ХБП, осложненным бесплодием, выявлено не было (48,3±5,1 млн/мл).
Видовой состав микробиоты, обсемененность эякулята и показатели встречаемости микроорганизмов в группах исследования представлены в табл. 1. Отмечено расширение видового состава микробиоты у всех пациентов с ХБП по сравнению со здоровыми: появлялись бактерии рода Escherichia, Klebsiella, Pseudomonas, Georgenia, Propionibacterium, Actinomyces и Kocuria. Повышение частоты встречаемости стафилококков увеличивалось в ряду: здоровые<пациенты с ХБП<пациенты с ХБП, осложненной бесплодием. Несмотря на то что частота встречаемости коринебактерий варьировалась от 20 до 26% во всех группах, обсемененность эякулята данными микроорганизмами была значительно ниже у пациентов с ХБП, осложненным бесплодием, по сравнению со здоровыми: lg 3,0±0,15 против lg 5,0±0,22 соответственно.
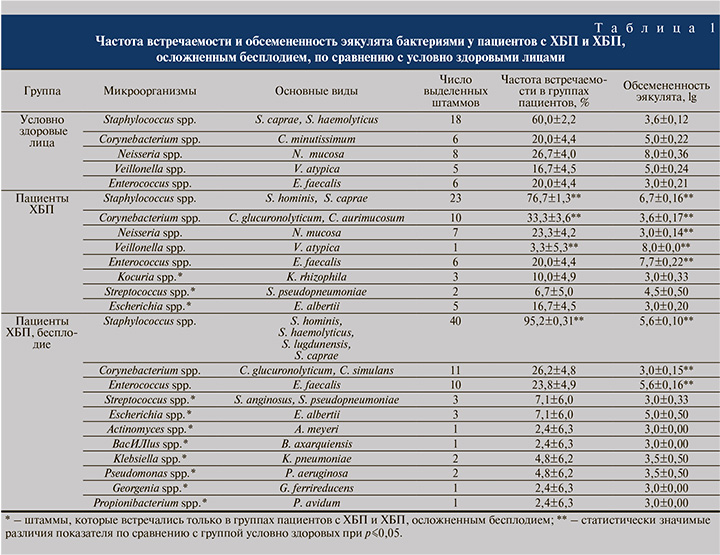
В работе также были изучены биологические свойства микробиоты с акцентом на их персистентные характеристики (табл. 2). Сравнительный анализ показателей групп пациентов позволил установить, что наиболее «чувствительными» к изменяющимся условиям биотопа оказались коринебактерии, у которых было отмечено изменение 5 показателей биологических свойств: снижение БПО у штаммов, изолированных от пациентов с ХБП, осложненным бесплодием, по сравнению с ХБП и здоровыми лицами; увеличение АПА в отношении ФНО-α и ИФ-γ во 2-й и 3-й группах по сравнению с 1-й группой, а также увеличение значений АПА ИЛ-10 и -17 у штаммов в 3-й группе по сравнению с 1-й и 2-й.
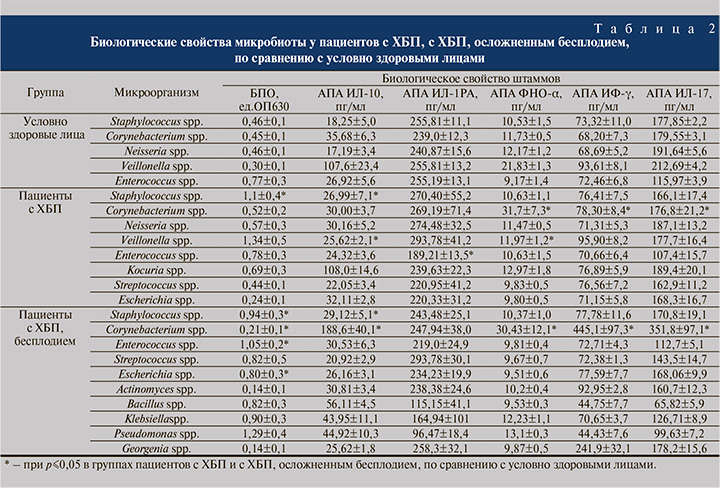
В изученных культурах стафилококков выявлено увеличение значений БПО у пациентов 2 и 3-й групп по сравнению с 1-й и АПА в отношении ИЛ-10 у больных 3-й группы по сравнению со здоровыми. У нейссерий отмечено усиление только ростовых свойств у пациентов с ХБП по сравнению со здоровыми. Напротив, бактерии рода Veillonella, изолированные от пациентов с ХБП, характеризовались снижением ростовых свойств, АПА в отношении ИЛ-10 и ФНО-α по сравнению со здоровыми. Также снижение значений БПО и АПА в отношении РАИЛ выявлено у энтерококков, выделенных из микросимбиоценоза пациентов 2-й группы по сравнению с 1-й группой. Что же касается штаммов эшерихий, отмечено снижение ростовых свойств на фоне увеличения БПО у пациентов с ХБП, осложненной бесплодием, по сравнению с пациентами с ХБП. Остальные показатели биологических свойств варьировались в зависимости от вида микроорганизмов и не различались между группами пациентов.
Исследование иммунологических параметров эякулята также выявило различия в сравниваемых группах пациентов (табл. 3).

При изучении цитокинового профиля спермоплазмы установлено повышение содержания ФНО-α, ИЛ-2, -6 у пациентов с ХБП, осложненным бесплодием, по сравнению с 1-й и 2-й группами. Исследование ИЛ-17 и IgA в эякуляте выявило повышение этих показателей у пациентов 2 и 3-й групп по сравнению с 1-й группой. Уровень ИЛ-1РA был снижен в группе пациентов с ХБП и повышен у больных ХБП, осложненным бесплодием. Уровень лактоферрина и лизоцима, напротив, повышался у пациентов с ХБП и снижался в группе пациентов с ХБП, осложненным бесплодием.
Обсуждение. Полученные результаты подтверждают выявленные в более ранних исследованиях [12] изменения ряда параметров спермограммы у лиц с ХБП и ХБП, осложненным бесплодием. Однако для понимания патогенеза простатита и объяснения негативного влияния простатита на мужскую фертильность необходимо дальнейшее изучение.
Известно, что основным этиологическим фактором ХБП являются грамотрицательные и грамположительные условно-патогенные микроорганизмы [13, 14]. Также показано, что уровень бактериоспермии у больных ХБП коррелирует с состоянием репродуктивного здоровья мужчин и наличием астеноспермии [11, 15, 16]. Наряду с этим микробиоценоз урогенитального тракта у больных ХП по сравнению со здоровыми лицами отличается меньшим видовым разнообразием микросимбионтов [16, 17]. Установленные особенности биотопа больных могут отражать микроэкологические нарушения в биоценозе урогенитального тракта при данной патологии. Именно по этой причине мы провели оценку видового состава и биологических характеристик микробиоты спермоплазмы пациентов. Как и ожидалось, больные в отличие от здорового персистентного потенциала (БПО, АПА) оказались высокочувствительными к инфекции, отражая адаптивную способность инфекта, что было установлено в других работах: микроорганизмы, выделенные от больных ХП с выраженными клиническими проявлениями и осложненным бесплодием, обладают высокими значениями антилизоцимной и антикомплементарной активности [11].
В то же время персистенция бактерии, способность инактивировать лизоцим, по-видимому, обусловливают дефицит лизоцима в спермоплазме. Это подтверждается данными уровня лизоцима у пациентов с ХБП, осложненным бесплодием. Кроме того, у данной группы пациентов была выявлена лейкоспермия, указывающая на хронический характер процесса. Нельзя исключать, что снижение уровня лизоцима является одним из механизмов увеличения вязкости эякулята. Все это подтверждает, что именно длительно персистирующая микрофлора приводит к бесплодию. В то же время уровень цитокинов (ИЛ-1РA, -2, -6, -17, ФНО-α) в семенной плазме был повышен у больных ХБП, осложненным бесплодием. Следовательно, цитокины семенной плазмы могут участвовать в различных патологических состояниях, связанных с мужским бесплодием, и нарушать функцию сперматозоидов. С другой стороны, выявленные в работе изменения антипептидной активности микробиоты в отношении цитокинов (ФНО-α, ИЛ-1РA, ИЛ-6, ИЛ-17), также могут вносить свой вклад в нарушение иммунного гомеостаза биотопа, приводя к формированию очага хронической инфекции. Не исключено, что функциональная система «цитокин–антипептидная активность» наряду с описанной ранее системой «лизоцим–антилизоцимная активность» [11], отражающей симбиотические отношения человека и его микробиоты, может иметь диагностическое значение при формировании ХБП, в том числе при формировании бесплодия. Эти материалы хорошо вписываются в инфектологическую структуру «паразит–хозяинных отношений» при персистирующей микробиоте [10].
Заключение. Представленное исследование – это обнадеживающая попытка использования инфектологического подхода при изучении ХБП. Совокупность отношений «паразит–хозяин» на симбиотической платформе открывает новые возможности решения фундаментальных и прикладных задач медицины с акцентированием внимания на персистентный потенциал возбудителей патологии (хронический бактериальный простатит). Персистентные характеристики микробиоты (антипептидная активность) в совокупности с цитокиновым профилем хозяина могут быть рекомендованы в качестве биомишени для диагностических, профилактических и лечебных мероприятий при ХБП.



