Введение. Аугментационная уретропластика (АУ) – метод, широко используемый в лечении протяженных стриктур уретры (СУ) [1]. При этом в качестве пластического материала применяются кожа, влагалищная оболочка яичка, слизистая мочевого пузыря, подслизистая оболочка тонкой кишки [2–4]. Однако самая высокая результативность при АУ достигнута в последнее десятилетие при восстановлении уретры трансплантатами слизистой ротовой полости (губы, щеки, языка) [5, 6]. Несмотря на длительную историю метода (с начала 1990-х гг.), естественная морфологическая динамика трансплантируемых тканей после переноса их на материнское ложе остается не до конца изученной как в клинике [7, 8], так и в эксперименте [9–12]. Гистопатологическая эволюция трансплантатов слизистой губы, щеки после АУ и воздействия мочи, возможно, имея отличия от заместительной пластики уретры, нуждается в дополнительном изучении, что и определило цель настоящей работы.
Материалы и методы. С 2015 по 2017 г. проведено исследование, одобренное локальным этическим комитетом (№ 21/15 от 10.12.2015), в которое включены 15 больных в возрасте 19–67 лет с первичными (3,5–11 см) пенильными и пенильно-бульбарными СУ. Клинически диагноз СУ был установлен на основании данных ретроградной уретрографии и цистоуретрографии при микции, урофлоуметрии и в отдельных случаях – уретроцистоскопии.
Все пациенты перенесли двухэтапную уретропластику. На первом этапе выполняли вентральную и дорсальную уретротомии по Asopa с фиксацией трансплантата слизистой ротовой полости, марсупиализацию уретры с формированием двух неомеатусов. Через 6 мес. на втором этапе проводили тубуляризацию уретры. Во всех наблюдениях послеоперационный период протекал благоприятно на обоих этапах операции.
Осуществлен сравнительный анализ 5 образцов трансплантатов из щеки, 4 – из нижней губы после их забора из ротовой полости и через 6 мес. после их приживления в уретре, полученных в ходе операции второго этапа. В других 6 случаях имел место рецидив СУ после второго этапа операции и через 12–24 мес. после трансплантации больные были повторно оперированы с забором образцов тканей трансплантата на границе со стенозом собственной уретры пациента, а также зоны стеноза.
Все образцы ткани немедленно помещали в нейтральный забуференный 10%-ный формалин с последующей спиртовой проводкой в автоматизированном тканевом процессоре закрытого типа Sakura (Япония). Полученные срезы толщиной 5–6 мкм окрашивали гематоксилином и эозином и пикрофуксином по Ван–Гизону. Верификацию результатов осуществляли на микроскопе Axioscop 40 («Zeiss») и документировали с помощью видеоприставки Sony Trinitron, совмещенной с компьютером ATHLON и феймграбером с программным обеспечением Mirro Video DC 20.
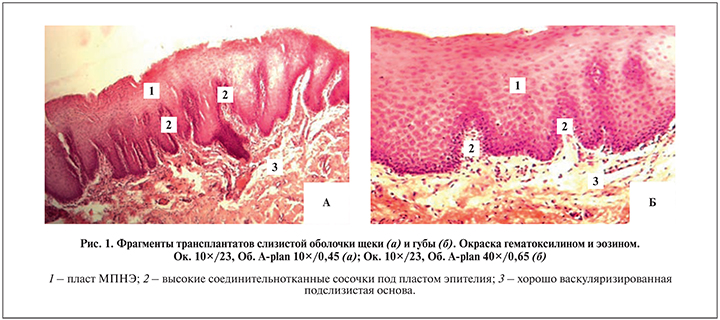
Результаты. Свежеизвлеченные ткани как с внутренней стороны щеки (рис. 1, а), так и нижней губы (рис. 1, б) покрыты характерным многослойным плоским неороговевающим эпителием (МПНЭ), расположенным на базальной мембране, состоящей из волокнистых структур. Собственная пластинка слизистой прилежала к базальной мембране, и ее плотная соединительная ткань, богатая клеточными элементами, формировала многочисленные выступы-сосочки, которые вдавались на различную глубину в эпителиальный слой. Глубокая же часть собственной пластинки переходила в подслизистую основу, богатую многочисленными мелкими сосудами и эластическими волокнами (см. рис. 1). Таким образом, исходно до трансплантации слизистая щеки и губы характеризовались нормальным строением и не имели структурных различий.
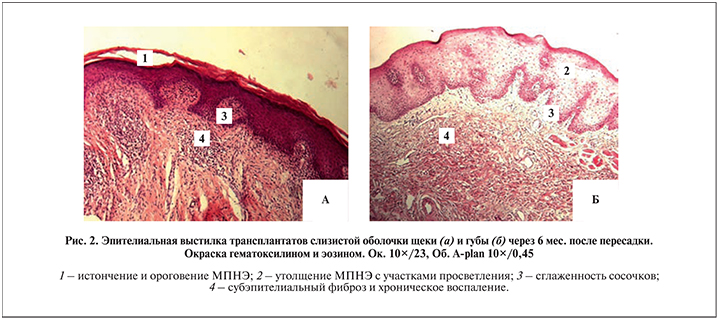
Общая структура трансплантатов через 6 мес. после их фиксации к межкруральному пространству полового члена оказалась полностью сохранной у всех пациентов (рис. 2). Вместе с тем имели место дистрофические изменения МПНЭ с некоторым нарушением его стратификации, паракератозом и фокусами перинуклеарного просветления. Трансплантаты слизистой щеки отличались значительно меньшей толщиной МПНЭ и наличием очагов его ороговения (рис. 2, а), чего не наблюдали ни в одном случае при исследовании трансплантатов губы (рис. 2, б).
В трансплантатах как щеки (рис. 3, а), так и губы (рис. 3, б) под эпителиальным пластом выявлена хроническая воспалительная реакция различной степени выраженности с наличием участков субэпителиального фиброза, проявлявшегося фуксинофилией и сопровождавшегося сглаживанием сосочков собственного слоя слизистой оболочки. В то же время в подслизистой основе хорошо визуализировалась сосудистая сеть (неоваскуляризация).
Ни в одном случае на эпителиальной поверхности трансплантатов не отмечено роста уротелия и признаков острой воспалительной реакции в форме гранулоцитарной инфильтрации.

Образцы трансплантатов, полученные через 12–24 мес. после пересадки по поводу сформировавшихся на стыке с нативной уретрой рецидивов СУ, также во всех случаях сохраняли свою структуру (рис. 4). При этом в трансплантатах нижней губы эпителиальный пласт имел неравномерную толщину с признаками паракератоза (см. рис. 4, б) в отличие от трансплантатов щеки, где отмечено его выраженное истончение, но без ороговения (см. рис. 4, а), которое было отмечено через 6 мес. после пересадки.
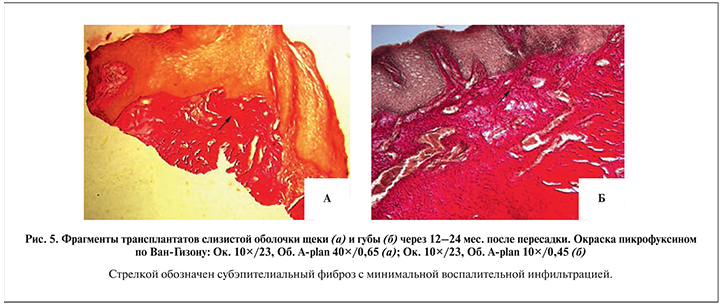
Во всех трансплантатах хроническая воспалительная реакция в субэпителиальных слоях наблюдалась лишь на небольших участках в минимальной степени выраженности в виде мелких скоплений лимфогистиоцитов. На всем протяжении трансплантатов в подслизистой основе сосудистая сеть была хорошо выражена, хотя на отдельных участках васкуляризация была несколько снижена вследствие субэпителиального фиброза (рис. 5).
В то же время сформировавшаяся стриктура в зоне анастомоза характеризовалась наличием склеротической и фиброзной соединительной ткани, покрытой уротелием, т.е. стенозированный анастомоз является тканью собственной уретры.

Обсуждение. Слизистая оболочка ротовой полости (губы, щеки) используется при аугментационной и заместительной уретропластике на протяжении более 20 лет, продемонстрировав высокие показатели успешности при средне- и долгосрочном наблюдении [13–15]. Примечательно при этом, что сведения об эволюции трансплантатов слизистой рта, помещенных в различные позиции в мужской уретре, крайне ограничены [7, 8]. Не многим больше исследований выполнено на животных [9–12].
Нами впервые проведено проспективное сравнительное исследование по гистопатологической эволюции двух видов трансплантатов слизистой ротовой полости (нижней губы и щеки), помещенных в пенильную и пенильно-бульбозную уретру по технике Asopa, выполненной всем больным по 2-этапному сценарию при длинных и тяжелых стенозах.
При среднесрочном контроле (6 мес.) нами обнаружено, что трансплантаты щеки и губы оказались структурно неповрежденными, они сохранили многослойный плоский эпителий, базальную мембрану, собственную пластинку и подслизистую основу с типичной васкуляризацией. Трансплантаты щеки имели очаги ороговения плоского эпителия в отличие от трансплантатов губы. Считается, что ороговение служит ответной реакцией на раздражение, особенно механическое, а таковое присутствовало у всех больных в связи с марсупиализацией уретры и ее прямым контактом с одеждой. Оба вида трансплантатов содержали в собственной пластинке элементы хронической воспалительной реакции и участки субэпителиального фиброза. Аналогичные феномены были ранее описаны и в экспериментах на животных [10–12], но не при использовании техники Asopa.
В случаях рецидива СУ спустя 6–18 мес. после тубуляризации трансплантата в области его стыка с собственной уретрой было отмечено снижение выраженности хронической воспалительной реакции и отсутствие ороговения плоского эпителия, т.е. контакт трансплантата с мочой не способствовал усилению воспаления и субэпителиального фиброза, более того, эти феномены были менее выражены, чем на сроке 6 мес. Состояние структуры трансплантатов через 12–24 мес. после пересадки в зоне сужения уретры оставалось ненарушенным, обращала внимание только тенденция к истончению многослойного эпителия щеки по сравнению с трансплантатом губы.
Таким образом, можно заключить, что не трансплантат является источником формирования рецидива СУ и участником этого процесса. Как показало исследование, рецидив СУ формируется на стыке трансплантата и собственной уретры в тканях самой уретры. Скорее всего, причиной этого процесса является сохранение и прогрессирование хронической воспалительной реакции в концевых участках собственной уретры, что обусловливает прогрессирование фиброза. Если это так, то задача хирурга при определении границ сужения уретры, подлежащей аугментации, более прецизионно оценивать состояние слизистой и спонгиозы в пределах хирургического доступа.
Возможно, эволюция тех или иных трансплантатов слизистой ротовой полости, помещаемых в различные позиции резецированной или рассеченной продольно уретры, будет иной, т.е. вид уретропластики также может влиять на эволюцию трансплантатов, и это следует определить в будущем.
Настоящее исследование не свободно от ограничений. Наши результаты касаются только 2-этапной операции Asopa, и их не следует прямолинейно экстраполировать на одноэтапную операцию Asopa и другие техники уретропластик. Кроме того, мы не исследовали образцы ткани трансплантатов при долгосрочных наблюдениях после успешных операций. В связи с этим экстраполировать наши результаты на успешные операции следует с осторожностью.
Выводы
- Трансплантаты слизистой нижней губы и щеки, интегрированные в уретру по технике 2-этапной операции Asopa, полностью сохраняют свою гистологическую структуру в течение 1–2 лет, что позитивно отличает их от других материалов, применяемых для АУ.
- Трансплантаты слизистой ротовой полости (губы и щеки) не являются структурной частью рецидивов стриктуры уретры, возникающих в зоне анастомоза трансплантата и собственной уретры.



