Введение. В настоящее время пероральные препараты группы ингибиторов фосфодиэстеразы 5-го типа (ФДЭ-5) служат терапией первой линии лечения эректильной дисфункции [1]. В России доступны четыре препарата: силденафила цитрат, тадалафил, варденафил и уденафил [2]. Силденафил относится к препаратам с самым быстрым началом действия. Он с успехом применяется в дозировке от 25 до 100 мг пациентами с эректильной дисфункцией вне зависимости от ее этиологии и длительности существования [3], в том числе пациентами с сопутствующей соматической патологией [4, 5]. Препарат отвечает основным требованиям, предъявляемым к препаратам перорального лечения: простой и незаметный прием в течение сравнительно короткого промежутка времени до сексуальной активности, высокая эффективность, хорошая переносимость, высокая селективность фармакологического действия, отсутствие влияния на ЦНС, быстрое всасывание и короткий период полураспада, обеспечивающий необходимую продолжительность действия [2].
С недавнего времени стали доступными альтернативные лекарственные формы ингибиторов ФДЭ-5, обладающие рядом преимуществ: не требуют проглатывания таблеток, обеспечивая удобство применения, позволяют избегать появления неприятных ощущений, возникающих при проглатывании [6]. В 2019 г. в России был зарегистрирован силденафил в новой лекарственной форме в виде спрея [12]. С целью оценки фармакокинетики силденафила в форме спрея при приеме натощак и после приема пищи проведено два открытых исследования.
Материалы и методы. Препараты. Действующим веществом тестируемого (T) и референтного (R) препаратов является силденафил. Тестируемый препарат в лекарственной форме «спрей для приема внутрь дозированный (12,5 мг/доза)» представляет собой водно-спиртовой раствор силденафила. В связи с тем что в рамках изучения биодоступности различные лекарственные формы для приема внутрь с немедленным высвобождением признаются одной и той же лекарственной формой [7], в качестве референтного препарата использованы таблетки силденафила. Препараты принимали в дозе 50 мг, что обеспечивало минимальный риск возникновения побочных явлений и надежное определение концентрации действующего вещества.
Участники и дизайн исследований. Участниками исследования были взрослые мужчины с верифицированным диагнозом «здоров». Для определения наличия критериев включения и невключения в рамках скрининга проводился сбор демографических и антропометрических данных, сбор анамнеза, физикальный осмотр, инструментальные и лабораторные методы диагностики, включая клинический и биохимический анализы крови, общий анализ мочи, ЭКГ, тестирование для определения употребления психоактивных веществ (анализ мочи на психотропные и наркотические вещества, психоактивные лекарственные препараты и тест на наличие алкоголя в выдыхаемом воздухе). Все критерии включения и невключения для двух исследований перечислены в Приложении 1. Первое исследование было открытым рандомизированным (1:1) сбалансированным по количеству участников, перекрестным в двух последовательных периодах с однократным приемом внутрь натощак силденафила (спрей и таблетки) на 44 взрослых здоровых добровольцах. Опираясь на данные ранее проведенных исследований силденафила в таблетированной форме в дозировке 100 мг [8, 9], представлялось целесообразным включить в исследование 44 мужчины.
Исследование состояло из периода скрининга, двух периодов приема препаратов (период наблюдения составлял 34 ч) и отмывочного периода (7 дней). Препараты принимали, запивая водой. В каждом периоде у добровольцев проводился забор 22 образцов крови в количестве 5–6 мл в дискретные интервалы времени по следующей схеме: за 10–15 мин до приема препарата (00:00) и после приема препаратов через 15 мин (00:15), 30 (00:30), 40 (00:40), 50 мин (00:50), 1 ч (01:00), 1 ч 15 мин (01:15), 1 ч 30 мин (01:30), 1 ч 45 мин (01:45), 2 ч (02:00), 2 ч 20 мин (02:20), 2 ч 40 мин (02:40), 3 ч (03:00), 3 ч 30 мин (03:30), 4 (04:00), 5 (05:00), 6 (06:00), 8 (08:00), 10 (10:00), 12 (12:00), 16 (16:00) и 24 (24:00) ч.
Поскольку при назначении препарата режим приема пищи не регламентирован [12], а предыдущие исследования проводились натощак, представляло интерес изучение фармакокинетики в связи с приемом пищи. Проведено открытое нерандомизированное исследование, в ходе которого каждый доброволец (n=6) поэтапно получал 50 мг силденафила: 1) спрей под язык после приема пищи не запивая, 2) спрей в рот не вдыхая, после приема пищи запивая водой (200 мл) и 3) таблетку после приема пищи запивая. Исследование состояло из скрининга, трех этапов приема препаратов (каждый период наблюдения составил 24 ч) и двух отмывочных периодов (по 3 дня). На каждом из этапов исследования у добровольцев проводился забор 24 образцов крови по 4 мл: до приема препарата (в 00:00) и после приема препаратов через 5, 10, 15, 20, 30, 40, 50 мин, 1 ч, 1 ч 15 мин, 1 ч 30 мин, 1 ч 45 мин, 2 ч, 2 ч 20 мин, 2 ч 40 мин, 3 ч, 3 ч 30 мин, 4 ч, 5, 7, 9, 12, 16 и 24 фч. Исследования проводили с 5 по 25 октября 2017 г. и с 18 по 29 мая 2020 г. в ООО «Научно-исследовательский центр “Экобезопасность”».
Биоаналитическая методика. На каждом из этапов исследований у добровольцев проводился забор образцов крови в течение суток. Оценку биоэквивалентности проводили посредством высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием [10]. Методика валидирована в соответствии с требованиями Руководства по экспертизе лекарственных средств [11].
Фармакокинетические показатели. После однократного приема препаратов оценивали следующие параметры силденафила: 1) максимальную концентрацию (Cmax), 2) площадь под фармакокинетической кривой «концентрация–время» начиная с нулевого значения времени до времени последнего забора крови (AUC0-t). Дополнительными параметрами были: 1) AUC от нулевого значения времени до бесконечности (AUC0-∞); 2) время достижения Cmax (Tmax) для силденафила и его активного метаболита N-десметилсилденафила.
Статистическая обработка данных. Анализ проведен с использованием статистического пакета R и Microsoft Office Excel, 2010. Применяли методы описательной статистики. Сравнение средних значений (Ср) фармакокинетических параметров проводили на основе мультипликативной модели. Статистическую значимость различий Тmax определяли с помощью двустороннего непараметрического T-критерия Вилкоксона. Биоэквивалентность оценивали путем расчета 90% доверительного интервала (ДИ) для отношения средних.
Этические аспекты. Исследования проведены в соответствии с международными стандартами надлежащей клинической практики (ICH GCP), надлежащей лабораторной практики (GLP), локальным законодательством и принципами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации. Исследования одобрены Советом по этике при Министерстве здравоохранения (выписка из протокола № 143 от 14.03.2017) и Локальным этическим комитетом ООО «Научно-исследовательский центр “Экобезопасность”» (выписка № 4 из Протокола заседания № 20 от 24.08.2017 и выписка № 1 из Протокола заседания № 134 от 19.03.2020). Все участники подписывали информированное согласие до начала исследования.
Результаты. Исследование биоэквивалентности. Скринингу были подвергнуты 50 здоровых добровольцев-мужчин, из которых 44 вошли в исследование. Методом рандомизации добровольцы были распределены в две сопоставимые группы по 22 человека. В ходе исследования один участник отказался от участия по причинам, не связанным с исследованием. Средний возраст составил 25 (18–43) лет, индекс массы тела – 23 (19–29) кг/м². Графики зависимости «концентрация–время» сравниваемых препаратов оказались сопоставимыми, что указывает на их биоэквивалентность (рис. 1).

Как видно из табл. 1, после однократного приема спрея натощак раньше достигалась Cmax в среднем через 51 мин по сравнению с препаратом сравнения – в среднем 62 мин (Z-value=-2,3, p=0,02).
При сравнении основных фармакокинетических параметров между препаратами (T/R) выявлено, что 90% ДИ укладывались в допустимый диапазон (80–125%), указывая на биоэквивалентность препаратов. Для силденафила 90% ДИ отношения средних значений Cmax T/R составил 82–106%, для значений AUC0-t 90% ДИ равен 82–101%; для N-десметилсилденафила 90% ДИ для показателей Cmax и AUC0-t составил 89–118 и 86–107 % соответственно. Время достижения ½ Cmax для силденафила-спрея составило 15±9 мин, для референтного препарата – 33±11 мин (p<0.05). Кроме того, выявлено, что отношение AUC0-∞/AUC0-t, силденафила и N-десметилсилденафила превышало 0,8 для всех субъектов, что позволяет сделать вывод о достаточной длительности наблюдения за профилем «концентрация–время».
Исследование влияния приема пищи. Медиана возраста вошедших в исследование 6 здоровых добровольцев-мужчин составила 29 (23–35) лет, индекса массы тела – 26 (23–29) кг/м2. Визуальный анализ показал, что силденафил после приема спрея определялся через 10 мин, а после приема таблетированной формы – через 30 мин (рис. 2). Вероятно, при приеме таблетированной формы эффект наступает позднее, чем после спрея.
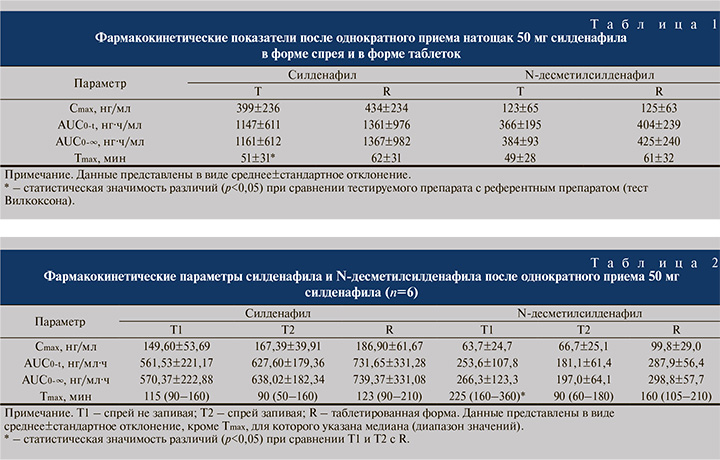
В табл. 2 представлены фармакокинетические параметры силденафила и N-десметилсилденафила в трех вариантах приема силденафила. Диапазон Tmax силденафила после приема спрея под язык после приема пищи не запивая (Т1) варьировался от 1 ч 30 мин до 2 ч 40 мин, для спрея в рот запивая (Т2) – от 50 мин до 2 ч 40 мин и для референтного препарата (R) – от 1 ч 30 мин до 3 ч 30 мин. Значимые различия выявлены между показателями Tmax N-десметилсилденафила после приема спрея не запивая (T1) и R (значение T-критерия Вилкоксона=1,9, p=0,06).
Обсуждение. Исследование двух лекарственных форм натощак показало отсутствие различий по основным фармакокинетическим параметрам, 90% ДИ для силденафила находились в диапазоне от 80 до 125%, что соответствует требованиям исследований биоэквивалентности [7]. Спрей характеризуется более ранним достижением Cmax по сравнению с таблетированной формой препарата, что может иметь большую клиническую ценность.
Результаты второго исследования показали, что при приеме спрея силденафила после еды Cmax силденафила достигается быстрее, чем после приема таблетки. Несмотря на отсутствие статистической значимости различий по показателю Tmax между препаратами, более раннее определение в крови метаболита и более короткий Tmax могут обеспечивать более раннее начало терапевтического эффекта. Это важный фактор, обеспечивающий более удобный для пациента прием и большую удовлетворенность.
Заключение. Таким образом, на рынке доступна альтернативная пероральная лекарственная форма препарата, которая обладает преимуществами по сравнению с обычными таблетками: 1) быстрое действие как натощак, так и после приема пищи, 2) удобное применение для пациентов, которые испытывают трудности при проглатывании таблеток. Исследования проводились на ограниченном количестве здоровых, молодых добровольцев, которые могут представлять группу быстрых метаболизаторов. Дальнейшие исследования могут быть направлены на изучение фармакокинетики и эффективности на выборке пациентов с эректильной дисфункцией. Удовлетворенность от приема препаратов является индивидуальной характеристикой [12], следовательно, в будущих исследованиях необходимо учитывать личные предпочтения пациентов и ожидания от приема препарата.
Приложение 1
Критерии включения и невключения в исследование биоэквивалентности (n=44)
Критерии включения:
1. Мужчины в возрасте 18–45 лет.
2. Верифицированный диагноз «здоров»: отсутствие патологии со стороны эндокринной системы, желудочно-кишечного тракта, печени, почек, сердечно-сосудистой системы, ЦНС (предварительно проведенные стандартные клинико-лабораторные и инструментальные исследования не выявили наличия каких-либо заболеваний и отклонений от нормы).
3. Индекс массы тела (ИМТ) находится в нормальных пределах (≥18,5 кг/м2 и ≤30 кг/м2).
4. Некурящие или бросившие курить более чем за 3 мес. до момента скрининга.
5. Согласие добровольца и партнерши добровольца придерживаться адекватных методов контрацепции на протяжении всего исследования.
6. Отрицательный тест на содержание алкоголя в выдыхаемом воздухе.
7. Отрицательный тест на содержание в моче наркотических и психоактивных лекарственных средств.
8. Наличие письменного согласия добровольца на включение в исследование.
9. Способность добровольца следовать требованиям протокола исследования, в том числе строго соблюдать инструкции по применению препаратов исследования.
Критерии невключения:
1. Лица, имеющие хотя бы один из перечисленных ниже признаков, не были включены в исследование.
2. Гиперчувствительность к силденафилу и вспомогательным компонентам сравниваемых лекарственных препаратов.
3. Острые и хронические заболевания сердечно-сосудистой, нейроэндокринной системы, а также заболевания желудочно-кишечного тракта, печени, почек, крови, в том числе:
a. Применение лицами, получающими постоянно или с перерывами донаторы оксида азота, органические нитраты или нитриты в любых формах, поскольку силденафил усиливает гипотензивное действие нитратов;
b. Совместное применение ингибиторов ФДЭ5, включая силденафил, со стимуляторами гуанилатциклазы, такими как риоцигуат, так как это может приводить к симптоматической гипотензии;
c. Одновременное применение с другими средствами лечения эректильной дисфункции;
d. Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция;
e. Тяжелая печеночная недостаточность (класс С по классификации Чайлд–Пью);
f. Одновременный прием ритонавира;
g. Тяжелые сердечно-сосудистые заболевания (тяжелая сердечная недостаточность, нестабильная стенокардия, перенесенные в течение последних шести месяцев инсульт или инфаркт миокарда, жизнеугрожающие аритмии, гипертензия [АД более 170/100 мм рт.ст.] или артериальная гипотензия [АД менее 90/50 мм рт.ст.]);
h. Лица с эпизодами развития неартериитной передней ишемической нейропатии зрительного нерва с потерей зрения в одном глазу;
i. Наследственный пигментный ретинит.
4. Любое заболевание, требующее постоянной сопутствующей терапии, включая применение растительных препаратов, или предвидимая потребность в сопутствующей терапии во время исследования.
5. Анатомическая деформация полового члена (ангуляция, кавернозный фиброз или болезнь Пейрони).
6. Прием витаминов, пищевых добавок и лекарственных препаратов, включая растительные лекарственные препараты и лекарственные растения (например, чеснок), в течение 14 дней до приема первой дозы препарата и на всем протяжении исследования. Прием препаратов зверобоя [Hypericum perforatum] за 30 дней до начала исследования и на всем протяжении исследования.
7. Систолическое АД менее 100 или более 130 мм рт.ст.; диастолическое АД менее 70 или более 90 мм рт. ст.; ЧСС менее 60 или более 90 уд/мин в покое.
8. Отклонения данных лабораторных тестов от референтных значений лаборатории исследовательского центра.
9. Хирургические вмешательства на желудочно-кишечном тракте (за исключением аппендэктомии).
10. Острые инфекционные заболевания менее чем за 4 нед. до начала исследования.
11. Прием лекарственных препаратов, оказывающих выраженное влияние на гемодинамику, функцию печени и др. (барбитураты, омепразол, циметидин и т.д.), менее чем за 30 дней до начала исследования и на всем протяжении исследования.
12. Донорская сдача крови (450 мл крови или плазмы и более) или потеря 500 мл или более крови за 3 мес. до первого приема исследуемого препарата.
13. Положительный анализ на ВИЧ, гепатиты В и С, а также сифилис.
14. Любые психологические, эмоциональные проблемы, любые расстройства, которые могут помешать подписанию информированного согласия, или ограничить возможность добровольца следовать требованиям протокола.
15. Невозможность дать письменное информированное согласие или следовать требованиям протокола.
16. Вероятность отказа следовать требованиям протокола, инструкциям и ограничениям; например, нежелание сотрудничать, невозможность вернуться в клинический центр для последующих визитов наблюдения и вероятность незавершения участия в клиническом исследовании.
17. Участие в клинических исследованиях препаратов менее чем за 3 мес. до начала исследования.
18. Злоупотребление кофеин-содержащими продуктами (500 мг кофеина или 5 чашек кофе в день) и невозможность отказаться от кофеин-содержащих продуктов, по крайней мере на 48 ч перед приемом первой дозы исследуемого препарата и до забора последней пробы крови в каждом периоде исследования.
19. Наркотическая зависимость в анамнезе. Положительный тест мочи на психотропные и наркотические вещества, психоактивные лекарственные препараты.
20. Регулярное употребление алкоголя в количестве 10 единиц (1 ед. алкоголя эквивалентна ½ л пива, 200 мл вина или 50 мл крепких спиртных напитков) в неделю. Употребление алкоголя в течение 48 ч до визита скрининга.
21. Применение ксантин-содержащих продуктов в течение 48 ч до скрининга.
22. Злоупотребление алкоголем в анамнезе или в настоящее время по данным наблюдающего врача. Положительный дыхательный тест на алкоголь на скрининге.
23. Прием пищи или напитков, содержащих грейпфрут, китайский грейпфрут (помело) или севильский апельсин (включая мармелад) в течение 10 дней до первого приема исследуемого препарата и невозможность прекратить прием этих продуктов во время исследования.
24. Затруднения при проглатывании таблеток.
Критерии включения и невключения в научно-исследовательскую работу (n=6)
Критерии включения:
1. В исследование были включены добровольцы, отвечавшие следующим критериям.
2. Здоровые добровольцы мужского пола от 18 до 45 лет (включительно).
3. Наличие письменного согласия добровольца на участие в исследовании, согласно действующему законодательству.
4. Индекс массы тела (ИМТ) в пределах 18,5≤ИМТ≤ 30 кг/м2 при массе тела не менее 45 кг и не более 100 кг.
5. Верифицированный диагноз «здоров».
6. Некурящие или бросившие курить в течение более 3 мес. к моменту скринингового периода.
Критерии невключения:
1. Гиперчувствительность к силденафилу и/или любому другому компоненту лекарственных препаратов.
2. Отягощенный аллергологический анамнез.
3. Наследственная непереносимость лактозы, дефицит лактазы и синдром мальабсорбции глюкозы-галактозы.
4. Хронические заболевания сердечно-сосудистой, бронхолегочной, заболевания нейроэндокринной, пищеварительной, мочевыделительной, кроветворной, иммунной и опорно-двигательной систем, психические заболевания в анамнезе.
5. Наличие эпизодов развития неартериитной передней ишемической нейропатии зрительного нерва с потерей зрения в одном глазу в анамнезе.
6. Наследственный пигментный ретинит.
7. Анатомическая деформация полового члена (ангуляция, кавернозный фиброз или болезнь Пейрони).
8. Заболевания, предрасполагающие к развитию приапизма (серповидно-клеточная анемия, множественная миелома, лейкоз, тромбоцитемия) в анамнезе.
9. Заболевания, сопровождающиеся кровотечением в анамнезе.
10. Острые или хронические инфекционные заболевания (в том числе грипп, ОРВИ) в течение 30 дней до начала исследования.
11. Хирургические вмешательства на желудочно-кишечном тракте в анамнезе (за исключением аппендэктомии).
12. Регулярный прием донаторов оксида азота, органических нитратов или нитритов в любых формах, поскольку силденафил усиливает гипотензивное действие нитратов.
13. Совместное применение ингибиторов ФДЭ5, включая силденафил, со стимуляторами гуанилатциклазы, такими как риоцигуат, так как это может приводить к симптоматической гипотензии.
14. Одновременное применение с другими средствами лечения эректильной дисфункции.
15. Одновременный прием ритонавира или альфа-адреноблокаторов.
16. Прием любых лекарственных препаратов, включая витамины, растительные препараты, а также биологически активных добавок (БАД) в течение 14 дней до начала исследования.
17. Прием лекарственных препаратов, оказывающих выраженное влияние на гемодинамику, функцию печени и др. (барбитураты, омепразол, циметидин и др.), пероральных антикоагулянтов, препаратов, метаболизирующихся изоферментом CYP2D6, менее чем за 2 мес. до начала исследования.
18. Показатели жизненных функций (ЖВП), выходящие за пределы референтных интервалов: САД менее 110 или выше 130 мм рт.ст.; ДАД менее 60 или выше 85 мм рт.ст.; ЧСС менее 60 или более 90 уд/мин; ТТ ниже 35,5 или выше 36,9°С, ЧДД более 22 дых.движ/мин.
19. Значения лабораторных показателей, выходящие за пределы референтных интервалов.
20. Прием более 10 ед. алкоголя в неделю (1 ед. алкоголя эквивалентна 0,5 л пива, 200 мл вина или 50 мл крепких спиртных напитков) или анамнестические сведения об алкоголизме, наркомании, злоупотреблении лекарственными препаратами.
21. Невозможность отказа от приема алкоголя за 72 ч до начала исследования.
22. Особая диета (например, вегетарианская, веганская, с ограничением употребления поваренной соли) или образ жизни (работа в ночное время, экстремальные физические нагрузки).
23. Употребление алкоголя, кофеина и ксантинсодержащих продуктов за 72 ч до начала исследования и невозможность отказаться от указанных продуктов до забора последней пробы крови в каждом периоде исследования.
24. Дегидратация из-за диареи, рвоты или другой причины в течение последних 24 ч до начала исследования.
25. Положительный результат обследования на ВИЧ 1-го и 2-го типов, сифилис (RPR), маркеры гепатита В (HВsAg) и С (HCV РНК).
26. Положительный тест на содержание алкоголя в выдыхаемом воздухе.
27. Положительный результат теста на выявление наркотиков в моче (кокаин, марихуана, амфетамин, метамфетамин, морфин).
28. Донорство (450 мл крови и более) в течение 30 дней до начала исследования.
29. Недоступность для наблюдения в течение исследования, невозможность соблюдения графика визитов, невозможность госпитализации в стационар на 1 сут., высокая вероятность возникновения проблем с успешной установкой венозного катетера или с выполнением пункции вены на предплечье.
Иные причины, которые, по мнению исследователя, препятствуют участию добровольца в исследовании или создают необоснованный риск.



