Введение. Заболеваемость раком предстательной железы в России с каждым годом увеличивается. Наряду с этим сокращается перечень противопоказаний к хирургическому лечению, растет частота выполняемых радикальных простатэктомий (РПЭ) при ожидаемой продолжительности жизни более 10 лет [1–3]. Как следствие – урологи чаще сталкиваются с проблемой эректильной дисфункции (ЭД), ассоциированной с операцией. Согласно определению Европейской ассоциации урологов, ЭД – это неспособность пациента достигать и поддерживать эрекцию полового члена, необходимую для выполнения удовлетворительного полового акта. До 25–75% всех прооперированных мужчин испытывают ЭД различной степени выраженности, что серьезно влияет на их качество жизни [1, 4]. В связи с этим ЭД представляется одной из самых актуальных проблем современной урологии, что диктует необходимость разработки мероприятий по предотвращению данного осложнения.
Существует несколько вариантов хирургического доступа при РПЭ – открытый и эндовидеохирургический (лапароскопический и роботический). Первая промежностная РПЭ была выполнена в 1867 г. немецким врачом T. Billroth. Однако основоположником метода считается американский уролог H. Young. В 1904 г. H. Young и W. Halsted успешно выполнили первую экстракапсулярную РПЭ. Новую эру открыл в 1945 г. T. Millin, использовавший позадилонный доступ для операции на предстательной железе [5, 6].
В 1991 г. операции стали выполняться из лапароскопического, а в 2000 г. – из роботического доступа [7]. И уже спустя 3 года появились первые данные о значительных преимуществах (функциональных и даже онкологических) робот-ассистированной РПЭ (РАПЭ) [8, 9].
В рекомендациях Европейского общества урологов отмечена мировая тенденция, согласно которой роботический доступ продолжает активно «вытеснять» позадилонный, поскольку преимущества в потенции наблюдаются уже спустя 12 мес. после операции [6, 10, 11]. Однако для выяснения функциональных или онкологических преимуществ РАПЭ перед РПЭ, выполненной прочими эндовидеохирургическими доступами – лапароскопическим трансперитонеальным (ТППЭ) и экстраперитонеоскопическим (ЭППЭ), необходимы дополнительные исследования [12].
Истинный прорыв в подходе к РПЭ совершили P. Walsh [13] и P. Donker [14], которые в 1982 г. одними из первых установили взаимосвязь между сохранностью нервных и сосудистых структур и эректильной функцией (ЭФ). Таким образом, было заявлено, что именно профилактика ЭД является первостепенным аргументом в пользу нервосберегающей РПЭ [15, 16]. Также авторы подробно описали анатомию дорсального венозного комплекса и сосудисто-нервных пучков (СНП), сформулировали ключевые принципы нервосберегающей техники. Благодаря исследованиям авторов начали выполняться РПЭ, основанные на нейроанатомии предстательной железы, что положило начало превентивному комплексному подходу к работе в области Ретциева пространства.
Цель данного исследования заключается в анализе сохранности эректильной функции после РПЭ в зависимости от вида доступа (ЭППЭ, ТППЭ и РАПЭ) и применения нервосбережения.
Материалы и методы
Дизайн исследования и характеристика пациентов
В период с февраля 2015 по февраль 2016 г. в клинике урологии Р. М. Фронштейна (Москва, Россия) было выполнено 507 РПЭ. В ретроспективное одноцентровое исследование был включен 231 пациент с локализованным (cТ1а–2с) РПЖ (ПСА<20 нг/мл, индекс Глисона ≤7) [6] и ожидаемой продолжительностью жизни более 10 лет. Пациенты были прооперированы одним хирургом, имеющим опыт выполнения открытых вмешательств. После преодоления восходящей кривой обучения хирурга пациенты рассматривались как кандидаты для данного исследования, а затем распределены на три группы в соответствии с хирургическим доступом, из которого была проведена РПЭ [5]. В группу ТППЭ вошли 75 пациентов, в группу ЭППЭ – 90 и в группу РАПЭ – 66. При выборе хирургического доступа в случае необходимости выполнения лимфаденэктомии предпочтение отдавалось лапароскопическому доступу, при настойчивом желании пациента сохранить ЭФ – роботическому или экстраперитонеоскопическому. С целью изучения результатов зависимости ЭФ от нервосбережения каждая из трех групп (ЭППЭ, ТППЭ и РАПЭ) была подразделена на две подгруппы в зависимости от сохранности нервных структур после операции.
 Всем пациентам было проведено комплексное обследование, на основании данных которого принималось междисциплинарное решение о выборе одного из трех рассматриваемых доступов и объеме операции. Для оценки коморбидности оценивали следующие параметры: возраст, индекс массы тела и риск прогнозируемых осложнений по заключению анестезиолога на основании шкалы физического статуса ASA-PS (American Society of Anesthesiologists – Physical Status) [17].
Всем пациентам было проведено комплексное обследование, на основании данных которого принималось междисциплинарное решение о выборе одного из трех рассматриваемых доступов и объеме операции. Для оценки коморбидности оценивали следующие параметры: возраст, индекс массы тела и риск прогнозируемых осложнений по заключению анестезиолога на основании шкалы физического статуса ASA-PS (American Society of Anesthesiologists – Physical Status) [17].
Чтобы клинически обоснованно подходить к отбору пациентов для нервосбережения, мы применяем номограммы Бриганти и таблицы Партина, на основании которых можно ориентировочно оценить риск прогрессирования заболевания (вероятность экстрапростатического роста опухоли, вовлечения семенных пузырьков и распространения на лимфатические узлы) [18, 19]. Пациентам среднего онкологического риска (уровень простатспецифического антигена [ПСА] 10–20 нг/мл, или индекс Глисона 7, или стадия cT2b), а также при риске поражения лимфатических узлов, превысившем 5% по номограмме Бриганти, была выполнена тазовая лимфаденэктомия в расширенном объеме, так как выполнение лимфаденэктомии менее, чем из пяти анатомических зон, снижает точность патоморфологического стадирования и ухудшает онкологический прогноз [6, 20]. Для контроля ранних онкологических результатов учитывали уровень ПСА в динамике с интервалом 3 мес.: повторное превышение порогового значения 0,2 нг/мл при двух последовательных измерениях трактовалось как биохимический рецидив [21].
Оценку ЭФ до операции проводили всем пациентам по шкале Международного индекса эректильной функции (МИЭФ-5) [22, 23]. Анализ ЭД как осложнения выполненной РПЭ проведен исключительно для пациентов с исходным показателем 19 и более баллов по шкале МИЭФ-5.
Среди пациентов не было больных сахарным диабетом и инсультом в анамнезе и катамнезе [24]. Качество жизни урологических больных оценивали по одноименной шкале QoL (Quality of Life) [25, 26].
Всем пациентам для профилактики и коррекции нарушений ЭФ в послеоперационном периоде было назначено медикаментозное лечение ингибиторами фосфодиэстеразы пятого типа (ФДЭ-5) [27]. Также при выписке пациент получал рекомендации о повторной консультации в отделении через 3 мес. после сдачи ПСА или ранее в случае возникновения жалоб.
Хирургическая техника
Оперативное лечение выполнено одним из трех эндовидео-хирургических доступов. Для ЭППЭ рабочее пространство для операции создавали с помощью диссекционного баллона, проведенного в Ретциево пространство. В дальнейшем устанавливали структурный порт и четыре рабочих порта (11 мм, 10 и два порта по 5 мм). При ТППЭ количество портов было аналогично вышеописанному, однако они были расположены на 2–3 см выше. Роботические операции выполняли на системе da Vinci Si. Первым этапом выполняли лимфаденэктомию. Затем удаляли клетчатку с передней поверхности предстательной железы (дефатизация) с целью визуализации границы ПЖ и мочевого пузыря (МП). Следующим этапом осуществляли тракцию МП, которая в зависимости от доступа выполнялась следующим образом: при ТППЭ и ЭПЭ – посредством зажима Келли в краниальном направлении, при РАПЭ тракцию хирург осуществлял третьей рукой с помощью граспера. Вышеуказанное обеспечивало визуализацию области шейки МП – места предполагаемого пересечения передней полуокружности шейки. После пересечения шейки МП раздутый баллон катетера опорожнялся. Простату подтягивали посредством тракции за катетер с помощью лигатуры, заведенной через окончатый просвет катетера. Катетер выводили в надлобковой области и фиксировали зажимом – при ТППЭ и ЭПЭ, при РАПЭ аналогичная манипуляция выполнялась с помощью третьей роботической руки. Шейку МП при РАПЭ рассекали монополярными ножницами, при ЭППЭ и ТППЭ – ультразвуковым скальпелем. Выделение и пересечение семявыносящих протоков осуществлялось стандартно [28].
Предстательную железу выделяли без пересечения внутритазовой фасции и лонно-простатических связок. Простатическую ветвь половой артерии сохраняли при ее наличии [29]. Нервосбережение осуществлялось атермально интерфасциально до уретры. Ножки простаты клипировали биоинертными полимерными клипсами или двойной титановой лигатурной клипсой. Отсечение простаты от дорсального венозного комплекса и уретры выполняли при внутрибрюшном давлении 20 мм рт.ст. Дорсальный венозный комплекс прошивали полигликолидной нитью с насечками 3/0 15–23 см. Уретру пересекали холодными ножницами. На всех этапах стремились сохранить достаточную длину культи уретры. При всех РАПЭ была выполнена задняя реконструкция по Rocco, которая используется в нашей клинике рутинно. Для формирования анастомоза между уретрой и шейкой мочевого пузыря при ТППЭ и ЭППЭ использовали рассасывающийся моноволоконный шовный материал (3/0) с двумя иглами (5/8) общей длиной 26 см, для роботизированного вмешательства – монофиламентную нить (3/0) с насечками (две нитки 15 см с иглами 5/8, предварительно соединенные между собой).
После наложения анастомоза сухожильную дугу подшивали к мочевому пузырю. Препарат извлекали в контейнере через продленный троакарный разрез в околопупочной области. При необходимости дополнительный гемостаз осуществляли с помощью гемостатических губок из окисленной целлюлозы.
В послеоперационном периоде дренаж удаляли на первые сутки. Сроки удаления катетера варьировались в зависимости от данных о состоятельности пузырноуретрального анастомоза при контрольном цистографическом исследовании.
Морфологическая экспертиза
Все препараты были проанализированы на наличие положительного хирургического края, согласно мировому стандарту (International Society of Urological Pathology/American Joint Committee on Cancer guidelines) [30, 31].
Критерии включения, невключения и исключения
С согласия локального Этического комитета в исследование включены пациенты с низким риском экстрапростатической экстензии, по данным номограмм Партина (до T2c включительно, сумма баллов по Глисону<7 и ПСА<10 нг/мл) и шкале Бриганти. От всех пациентов получено информированное добровольное согласие на операцию [32, 33]. Критериями невключения в исследование послужили прогностически неблагоприятные факторы: проведенная неоадъювантная терапия (n=3), по данным патоморфологического заключения (n=3), адъювантная терапия в течение 12 мес. наблюдения (n=7). Критерии исключения были следующими: верификация метастатического поражения лимфатических узлов (n=2), стадия опухолевого процесса ≥pТ3а (n=16), а также отсутствие приверженности лечению ингибиторами ФДЭ-5 (n=1) и контролю ПСА каждые три месяца (n=1).
Статистическая обработка данных
Для множественных межгрупповых сравнений применяли непараметрический критерий Краскела–Уолеса. При наличии статистически подтвержденных различий между исследуемыми группами проводили парные сравнения по критерию Манна–Уитни. При оценке динамики показателей в связанных группах применяли непараметрический критерий Вилкоксона. Значимость различий качественных показателей в группах наблюдения оценивали при помощи непараметрического критерия Пирсона χ2. Для выявления корреляционных взаимосвязей между видом доступа, техникой нервосбережения и сохранностью ЭФ применяли коэффициент корреляции Спирмена. Для проведения многофакторного анализа использовали метод логистического регрессионного анализа.
Результаты. Радикальная простатэктомия с нервосбережением была выполнена 150 пациентам, без нервосбережения – 81. Методика не сопровождалась значимыми отличиями времени операции (180,0 [150,0–210,0] минут при сохранении СНП против 160,0 [130,0–200,0] минут без выполнения нервосбережения; р=0,064) и объема кровопотери (200,0 [100,0–300,0] мл против 200,0 [(150,0-400,0] мл соответственно; р=0,073).
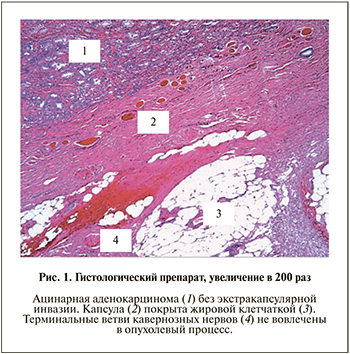
При патоморфологической экспертизе данных о наличии опухолевых клеток в зоне анастомоза не получено ни в одном случае (отрицательный хирургический край, R0). Кроме того, было верифицировано отсутствие прорастания опухоли в окружающие структуры – капсула сохранна (до рТ2с включительно, рис. 1).
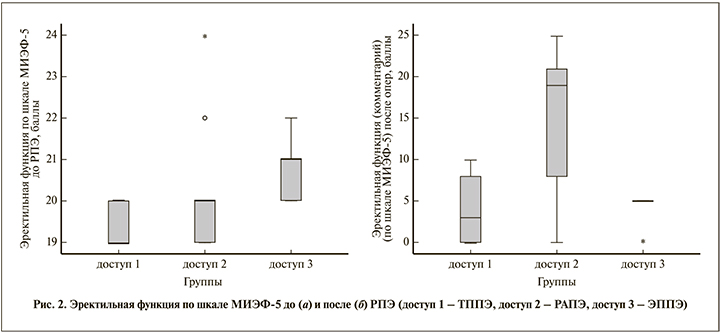
При анализе данных анкетирования (n=153) по шкале МИЭФ-5 учитывались результаты 57 пациентов, показатели которых в предоперационном периоде составили ≥19 баллов (ТППЭ, n=15; РАРП, n=15; ЭППЭ, n=27; рис. 2).
Исходные показатели выборок перед РПЭ статистически значимо не различались: 19,4±0,5 балла при ТППЭ, 20,22±1,65 – при РАПЭ и 20,8±0,78 – при ЭППЭ (р=0,154).
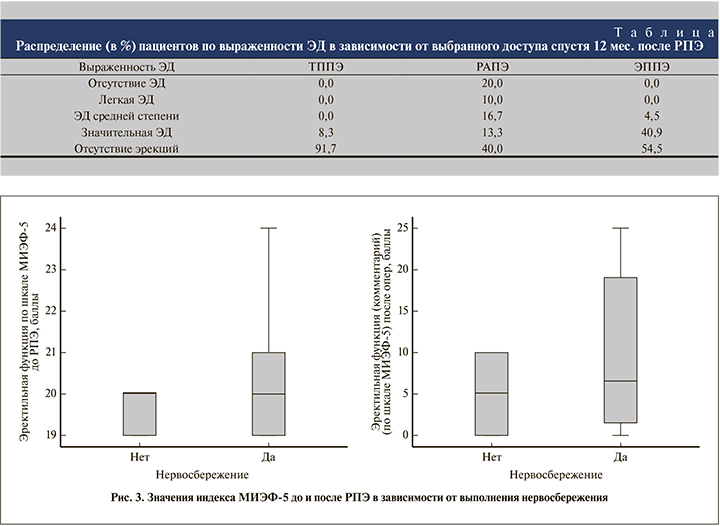
Проанализировав влияние доступа на восстановление ЭФ, мы получили следующие данные. К 12-му месяцу послеоперационного периода индекс МИЭФ-5 у 15 больных после РАПЭ составил 14,67±9,4 балла, у 15 больных после ТППЭ и 27 больных после ЭППЭ – 4,2±4,26 и 4±2,07 балла соответственно (р=0,002), что свидетельствует о более выраженном улучшении ЭФ после РАПЭ (табл. 1).
При разделении групп по принципу выполнения нервосбережения выявлено преобладание значительной степени ЭД и полной утраты функции у пациентов после РПЭ без нервосбережения по сравнению с группой, в которой были сохранены СНП (5,0 [0–10,0] против 6,5 [0,8–19,0] баллов по шкале МИЭФ-5; р=0,271): 96,2 против 72,2% (p<0,001; рис. 3).
Качество жизни
Спустя 12 мес. после операции всем пациентам было предложено оценить качество жизни при имеющихся у них урологических проблемах по шкале от нуля («прекрасно») до шести («очень плохо»). Баллы от нуля до четырех трактовались как удовлетворительное качество жизни; оно было достигнуто 94,8% опрошенных больных. По сравнению с двумя другими группами сравнения оптимальный результат достигнут в группе РАПЭ (р=0,002): 40 % оценили качество своей повседневной активности и ощущение как «хорошие», в то время как в группах ТППЭ и ЭППЭ преобладало значение «в общем удовлетворительно» (56% после ТППЭ и 27,3% после ЭППЭ, р<0,001; рис. 4).
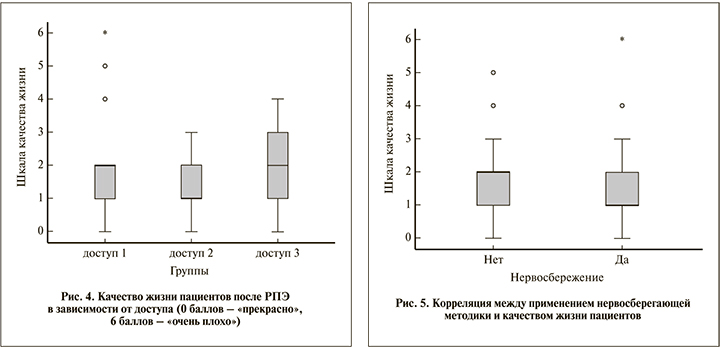
Нервосбережение оказало статистически значимое положительное влияние на качество жизни: 1,63±1,16 против 1,88±1,02 балла (р=0,035; рис. 5).
Обсуждение. Функциональные расстройства как осложнение РПЭ оказывают негативное влияние на качество жизни пациентов урологического профиля [26, 31].
Поскольку при нервосбережении работа в области СНП направлена на сохранение ЭФ, требуется не только прецизионная техника диссекции, но и минимизация использования электрохирургии в зоне кавернозных нервов. В связи с этим, как было отмечено рядом авторов [34], указанная техника может потребовать продления времени операции и сопровождаться увеличением объема кровопотери. При сравнении общих показателей операции, таких как объем кровопотери (р=0,073) и время операции (р=0,064), мы не получили статистически значимых различий.
При внутригрупповом (РАПЭ, ТППЭ и ЭППЭ) сравнении было показано, что наложение везикоуретрального анастомоза при двухмерном изображении по сравнению с трехмерным вызывает затруднения, поэтому достижение оптимальных результатов при использовании лапароскопического доступа представляется весьма трудной задачей по сравнению с роботической хирургией, при которой можно рассматривать возможность три- или пентафекты (сохранение ЭФ, восстановление континенции, отсутствие позитивного хирургического края, избежание осложнений в послеоперационном периоде и данных за биохимический рецидив), т.е. степень соответствия результатов РПЭ эталону [35–39].
Предикторами сохранения потенции являются следующие факторы: возраст, объем операции (в том числе возможность нервосбережения), а также уровень ЭФ в дооперационном периоде [40, 41]. В связи с этим в настоящем исследовании пациенты были разделены на группы однородные по перечисленным критериям. В мире наблюдается тенденция к более частому использованию оперативного лечения у старшей возрастной группы (старше 70 лет), так как с развитием оборудования и анестезиологического пособия соматические противопоказания теряют весомую аргументацию. Однако пропорционально увеличению возраста функция восстанавливается медленнее и с меньшей вероятностью. Р. Mandel et al. получили данные, согласно которым спустя 12 мес. после билатерального нервосбережения сохранность эректильной функции для возрастных групп ≥75; <75 и ≥ 0; ≥65 и <70; <65 лет составила 33,3%, 50,6%, 49,5% и 61,6% соответственно.
На сегодняшний день считается, что следует ожидать улучшения показателей в течение последующих 1–2 лет (к сроку 24–36 мес.), так как до 36,5% пациентов, страдающих ЭД в послеоперационном периоде, имеют тенденцию к постепенному восстановлению потенции [42]. Рядом авторов было показано преимущество качества ЭФ после операции по нервосберегающей методике, причем в объеме как билатерального, так и унилатерального сохранения СНП [40]. В представленном исследовании применение нервосбережения повлияло на функциональные результаты следующим образом. Изначальное показание – сохранение потенции у контингента заинтересованных пациентов – было достигнуто в полном объеме (МИЭФ-5 ≥ 19 баллов) только 12% (р<0,001) прооперированных, и полной утраты ЭФ после РПЭ на этапе наблюдения через 12 мес. ни у одного пациента отмечено не было (р<0,001). Кроме того, при РПЭ с сохранением СНП ЭД наблюдается значительно реже (46 против 88,5%, р<0,001). Однако, несмотря на то что в представленном исследовании демонстрируется статистически значимое преимущество качества потенции после роботического доступа по сравнению с двумя другими группами, у большинства пациентов имеет место ЭД легкой и средней степеней выраженности. Ряд авторов предлагают использовать шкалу EHS (Erection Hardness Score), которая позволит более корректно оценить степень послеоперационных нарушений даже у пациентов с относительно низкой степенью сексуальной активности [43].
В связи с отсутствием данных доказательной медицины следует признать, что попытка интраоперационного восстановления целостности нервов признана неэффективной, а сохранение добавочной половой артерии остается дискутабельным [42].
Согласно данным мультицентровых исследований США и Европы и опубликованных систематических обзоров, применение ингибиторов ФДЭ-5 после билатерального нервосбережения является терапией первой линии, направленной на восстановление ЭФ (35–75% по сравнению с 0–15% после РПЭ без нервосбережения) [1, 27]. Анализ данных семи плацебо-контролируемых рандомизированных клинических исследований, суммарно включивших 2215 пациентов, получавших препараты фармакологической группы ингибиторов ФДЭ-5 после нервосберегающей РПЭ, продемонстрировал преимущество приема препаратов перед плацебо. Установлено, что прием аванафила и варденафила более эффективен «по требованию» по сравнению с ежедневным, в то время как прием тадалафила характеризуется равной эффективностью (независимо от режима). Однако собственное исследование авторов показало оптимальные результаты при постоянном приеме низких доз последнего. Таким образом, выбор препаратов и режима применения остаются дискутабельными, но не возникает сомнений в их эффективности, в связи с чем их прием был критерием включения в исследования как один из факторов, позволяющих говорить о гомогенности выборки.
В ходе исследования были также получены первые данные о состоятельности функции континенции мочи. По нашим данным, нарушения функции удержания реже встречались в группе после РПЭ с сохранением СНП [15]. Предварительно также можно говорить о преимуществе сохранности и благоприятной динамике восстановления функции удержания мочи после нервосберегающей простатэктомии, исполненной роботическим доступом, по сравнению с двумя остальными вариантами доступа и без нервосбережения. Однако более релевантные выводы о достигнутых результатах можно сделать в момент преодоления рубежа в 24 мес. после операции. Поэтому данные о динамике восстановления будут освещены позднее.
Важно понимать, что решение об изменении объема операции в силу стремления к сохранению функции должно быть взвешенным, основанным на данных объективных методов диагностики (в отсутствие онкологических противопоказаний) и рассматриваться сугубо индивидуально. Крупные исследования убедительно демонстрируют, что каждый из критериев высокого риска независимо достоверно увеличивает риск прогностически неблагоприятного положительного, а также «близкого» («close») хирургического края (наличие злокачественных клеток на расстоянии 0,1 мм от хирургического края): стадия T3–T4 по сравнению с T1–T2 (HR – 2,68; 95% CI – 2,00–3,59; p<0,001), уровень ПСА >20 нг/мл по сравнению с ПСА<10 нг/мл (HR – 1,80, 95% CI – 1,06–3,05; p=0,029), сумма баллов по Глисону – 8–10 сравнительно с баллами 2–6 (HR – 2,25, 95% 1,39–3,63; p=0,001) [40, 41]. Выявление биохимического рецидива служит показанием к назначению гормональной терапии, после применения которой ЭФ, качество которой и так было скомпрометировано проведенным хирургическим лечением, может быть утрачена окончательно.
Таким образом, первостепенной целью РПЭ является избавление пациента от злокачественного субстрата онкологического заболевания и достижение безрецидивной выживаемости. В противном случае при выявлении рецидива возникает необходимость в продолжении лечения прогрессирующего онкологического процесса, что в большинстве случаев осложняется ЭД. При отсутствии данных о компрометации онкологического радикализма (при соблюдении Ro хирургического края, отсутствии данных о биохимическом рецидиве, благоприятных отдаленных результатах) метод может быть рассмотрен как целесообразный способ достижения качества жизни данной группы больных, так как обладает потенциалом сохранить функциональный статус мочеполовой системы [11, 45].
Согласно рекомендациям ЕАУ, отсутствие онкологических противопоказаний к нервосбережению у пациентов с промежуточным и высоким риском прогрессирования должно быть подтверждено данными мультипозиционной МРТ [46]. Однако в силу недостаточного внедрения в клиническую практику упомянутой технологии нами были применены неинвазивные номограммы Бриганти и Партина. Тщательная морфологическая экспертиза гистологических препаратов подтвердила корреляцию полученных данных о рисках экстрапростатической экстензии и верифицированном статусе «капсулы» предстательной железы.
Ограничения исследования: исследование выполнено в рамках одного учреждения и включает относительно небольшую группу пациентов; недостаточный срок наблюдения – 12 мес. после операции.
Заключение. Представленное исследование позволяет оценить влияние применения техники нервосбережения и вида оперативного доступа на результаты РПЭ. Выбор техники нервосбережения привел к улучшению ЭФ. Обозначенное преимущество без потери онкологического радикализма позволяет рассматривать нервосбережение как целесообразный и обоснованный метод предотвращения ЭД при РПЭ у правильно подобранной группы пациентов. Выбор того или иного хирургического доступа должен осуществляться, исходя из возможности их оптимального выполнения, патогенетической обоснованности, а также из особенностей физического статуса и пожеланий пациента. Несмотря на высокую вероятность того, что РПЭ может привести к ЭД (уровень доказательности 2b), использование роботизированной малоинвазивной хирургии способствует более прецизионному выполнению всех этапов операции, особенно ключевых манипуляций в области СНП, и способна оказать влияние на прогноз сохранения эректильной функции, как было показано в данном исследовании. Наиболее выраженная положительная динамика наблюдалась в группе РАПЭ, в которой в целом были получены наилучшие результаты.
Требуется дальнейшее наблюдение с целью мониторинга функциональных результатов в фиксированный срок, обозначенный рекомендациями Европейского общества урологов как 48 мес. с момента операции [4, 7] а также онкологических результатов в виде общей и безрецидивной пятилетней выживаемости. Персонализированный подход призван обеспечить оптимальные онкологические и функциональные результаты. Представленные данные многофакторного сравнительного анализа сопоставимы с данными мировой литературы.



