Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее часто встречаемых заболеваний мужчин зрелого возраста. Из специфических средств при ее лечении используют препараты для подавления активности изоферментов 5α-редуктазы и селективные конкурентные блокаторы постсинаптических α1-адренорецепторов [1]. Однако при гиперплазии простаты весьма часто встречаются патоморфологические изменения воспалительного характера (отечность ткани железы, микрокровоизлияния, клеточно-воспалительные инфильтраты), что определяет поиск новых терапевтических подходов к лечению ДГПЖ.
В связи с этим в качестве патогенетического средства лечения гиперплазии предстательной железы представляется весьма перспективным и обоснованным применение ректальных свечей с окисленным декстраном. Окисленный декстран представляет собой линейный полисахарид с м.М. 40 кДа, в котором часть глюкозных циклов раскрыта и количество карбонильных групп выше (до 10 и более), чем в неокисленной форме декстрана (только 1 концевая карбонильная группа). За счет этого окисленный декстран обладает значительно большей биологической активностью, чем неокисленная форма декстрана, и по спектру фармакологической активности он близок к β-1,3-гликанам. В частности, окисленный декстран обладает рецептор-опосредованной способностью активировать макрофаги, в результате чего они выделяют во внеклеточную среду комплекс противовоспалительных цитокинов и тканевых протеиназ, за счет чего наделяют этот «продукт» мощными противовоспалительными и антифибротическими свойствами, препятствуя образованию тромбов в микроциркуляторном русле [2–4]. Все эти фармакологические эффекты окисленного декстрана могут быть весьма востребованными в комплексном лечении ДГПЖ.
Цель настоящей работы: оценить терапевтическую активность окисленного декстрана при ректальном введении на сульпиридной модифицированной модели гиперплазии предстательной железы мышей. Базовая модель гиперплазии предстательной железы вызывается у крыс после в/м введения сульпирида из расчета 40 мг/кг массы тела в течение 30 дней [5].
Материалы и методы. Окисленный декстран с м.М. 40 кДа получали методом, описанным в патенте RU 2618341, опубл. 03.05.2017. Бюл. № 13. Для ректального введения мышам готовили 2%-ный водный раствор окисленного декстрана, содержащий в качестве вспомогательных веществ для стабилизации раствора 5% димексида, 0,25% Трилона Б и 10% полиэтиленоксида 1500. Для моделирования гиперплазии предстательной железы использовали фармакопейный сульпирид, раствор для внутримышечного введения с концентрацией 50 мг/мл производства АО «Органика» Россия. Перед введением мышам раствор сульпирида разбавляли водой для инъекций в соотношении 1:1, рабочая концентрация – 25 мг/мл. В качестве контрольного средства использовали фармакопейный поли-этиленоксид 1500 производства ООО «РусХимтрейд», Россия, который является одним из стандартных формообразующих наполнителей для ректальных свечей. Для ректального введения мышам готовили 10%-ный водный раствор полиэтиленоксида 1500. Ввиду технических сложностей изготовления и введения мини-суппозиториев компоненты ректальных свечей мышам вводили ректально в виде водных растворов в количестве 50 мкл на мышь. Все исследования in vivo выполнены на 30 мышах-самцах линии BALB/c со средней массой тела 30–35 г. Животные были получены из питомника ФИЦ «Институт цитологии и генетики» Сибирского отделения РАН (Новосибирск) и после 14-дневного карантина находились в стандартных условиях содержания и кормления. Сульпиридную модель гиперплазии предстательной железы мышей вызывали подкожным ежедневным введением рабочего раствора сульпирида (концентрация – 25 мг/мл) в течение 20 дней. Начиная с 21-го дня животным опытной (n=10) и контрольной групп (n=10) ректально в течение 7 дней ежедневно вводили контрольный 10%-ный водный раствор полиэтиленоксида по 50 или по 50 мкл 2%-ного водного раствора окисленного декстрана. В группе нелеченых животных (n=10) с 21-го по 28-й день ректально ежедневно вводили по 50 мкл физиологического раствора. На 29-й день всех животных подвергали эвтаназии методом дислокации шейных позвонков под эфирным наркозом. Объектом исследования служили гистологические образцы (срезы) ткани предстательной железы и мочевого пузыря мышей указанных групп исследования, окрашенные гематоксилином и эозином. Визуализацию осуществляли методом прямой световой микроскопии с использованием биологического прямого микроскопа AxioImager A1 c фотокамерой AxioCam MRc5 («Carl Zeiss», Германия) с инструментами программы AxioVision (rel. 4.12). Увеличение х200. В срезах образцов ткани мышей оценивали следующие патоморфологические изменения: степень выраженности отека, гемоциркуляторных нарушений, клеточной воспалительной инфильтрации, деструктивных изменений, очагов гиперплазии железистого эпителия, а также толщину мышечного слоя мочевого пузыря, толщину эпителия предстательной железы, площадь ядра и цитоплазмы клеток предстательной железы и ядерно-цитоплазматический коэффициент железистых эпителиальных клеток. Метод статистической обработки: полученные данные анализировали с помощью пакета программ «Statistica 10.0» (Statsoft). При определении вероятности различий сравниваемых средних величин использовали критерий Стьюдента. За уровень статистической значимости различий сравниваемых средних величин принимали р<0,05. Биологический эксперимент проведен в соответствии с национальным стандартом Российской Федерации «Принципы надлежащей лабораторной практики», утвержденным и введенным в действие Приказом Ростехрегулирования от 02.12.2009 (№ 544-ст, ГОСТ Р 53434-2009).

Результаты и обсуждение. Результаты исследования терапевтической активности окисленного декстрана на сульпиридной модели гиперплазии предстательной железы мышей представлены в таблице и на рис. 1–3. Группа нелеченых животных демонстрировала типичную картину повреждения предстательной железы: увеличение мышечного слоя мочевого пузыря с уменьшением его просвета и толщины эпителия предстательных желез за счет активной клеточной гиперплазии и застоем клеточного секрета в просвете. Отмечаются также единичные локусы кровоизлияний и отека, сосуды полнокровны (рис. 1).
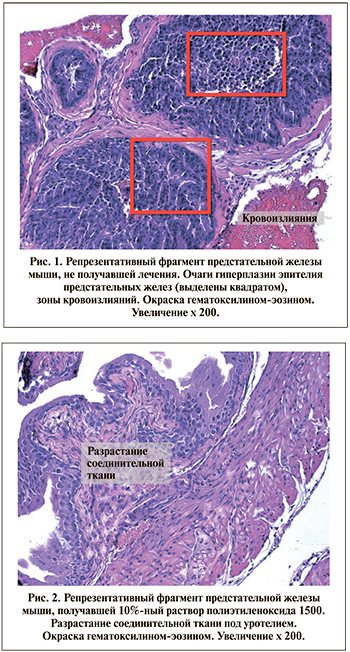
В группе животных, получавших 10%-ный раствор полиэтиленоксида 1500, отмечали снижение мышечного слоя мочевого пузыря и увеличение размеров клеток предстательных желез. Значительных различий по сравнению с группой нелеченых животных выявлено не было. Отличительной особенностью группы было разрастание соединительной ткани в подслизистом слое мочевого пузыря (после ряда эпителиальных клеток) (рис. 2) и небольшое асептическое воспаление (без примеси нейтрофилов).
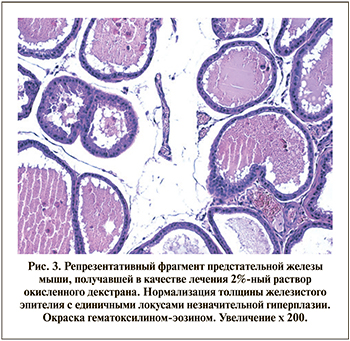
Группа животных, получавших в качестве лечения 2%-ный раствор окисленного декстрана, продемонстрировала в эксперименте наибольший терапевтический эффект, подтвержденный снижением размеров мышечного слоя мочевого пузыря и нормализацией его просвета. Толщина эпителия предстательных желез приближалась к значениям, характерным для интактных животных; очаги гиперплазии эпителия желез единичны. Отмечается местная стимуляция иммунитета – наличие асептического воспаления (без нейтрофилов), единичные сосуды полнокровны без тенденции к тромбированию (рис. 3).
Выводы. Окисленный декстран при ректальном введении демонстрирует высокую терапевтическую активность на экспериментальной модели доброкачественной гиперплазии предстательной железы мышей и может рассматриваться как один из наиболее перспективных компонентов для лекарственных композиций, применяемых в андрологической практике.



