Введение. Болезнь Паркинсона (БП) – это прогрессирующее, длительно протекающее заболевание, сопровождающееся дегенерацией преимущественно нейронов нигростриарной дофаминергической системы, вызванное накоплением патологических включений альфа-синуклеина. БП признана наиболее распространенным нейродегенеративным заболеванием после болезни Альцгеймера. По данным Всемирной организации здравоохранения, во всем мире БП по темпам роста инвалидности и смертности опережает другие неврологические расстройства [1].
Клиника БП складывается из триады основных симптомов – это тремор покоя, мышечная ригидность и гипокинезия. При данном неврологическом заболевании у 80% больных развивается клиническая картина гиперактивного мочевого пузыря вследствие отсутствия ингибирующего супрапонтинного влияния на центр мочеиспускания в головном мозге [2]. Кроме того, когнитивные нарушения могут развиваться уже на ранних стадиях БП, в 30% наблюдений они приводят к деменции [3].
Применение М-холиноблокаторов (М-ХБ) при лечении гиперактивного мочевого пузыря остаются одной из основных линий [4], при этом применение антимускариновых средств в течение длительного периода времени может повышать риск развития деменции [5]. Тем не менее М-ХБ обладают различными фармакологическими характеристиками (трансфер через гематоэнцефалический барьер, селективность в отношении мускариновых рецепторов и т.д.) и их влияние на центральную нервную систему может отличаться. Троспия хлорид относится к группе четвертичных аминов, что предположительно должно обеспечивать лучший профиль безопасности для пациентов с БП в течение длительного периода.
Цель исследования. Оценить эффективность длительного применения троспия хлорида (Спазмекса) при лечении больных нейрогенным гиперактивным мочевым пузырем (НГМП) вследствие БП и определить влияние терапии на когнитивный статус пациентов.
Материалы и методы. Больные БП, включенные в исследование, предъявляли жалобы на ургентные позывы к мочеиспусканию, учащенное дневное и ночное мочеиспускание, в ряде случаев на эпизоды ургентного недержания мочи. По данным урофлоуметрии ни в одном наблюдении не было выявлено снижения максимальной скорости потока мочи (Qmax). Критериями исключения были необходимость в изменении схемы противопаркинсонической терапии или назначение антихолинэстеразных препаратов; тяжелая коморбидная патология; наличие острых заболеваний, полиорганной недостаточности; отказ от участия в исследовании. Все пациенты подписали информированное согласие.
В основную группу отобраны 60 больных БП со стадиями 2,5, 3 и 4 по Хён-Яру. Средний возраст больных составил 58,2±5,7 года. Всем пациентам при включении в исследование был назначен троспия хлорид с постепенным титрованием дозы (от 30 до 90 мг) до клинической эффективности. Из них 21 человек переведен с терапии оксибутинином (9) или толтеродином (12) из-за центральных побочных эффектов (подгруппа 1); 8 – с мирабегрона в связи с недостаточной эффективностью (подгруппа 2), 31 – получил троспия хлорид в качестве первого препарата для лечения НГМП (подгруппа 3). Надо отметить, что препараты, которые предварительно получали пациенты подгрупп 1 и 2, не обладают кумулятивным эффектом, а период полувыведения оксибутинина гидрохлорида равняется 2 ч, толтеродина – 3–4, мирабегрона – 50 ч [6]. Тем не менее для нивелирования действия препаратов при их последовательном применении перерыв между их отменой и назначением троспия хлорида составил не менее 7 сут. За это время, как и следовало ожидать, у всех больных отмечено возвращение симптомов НГМП.
В группу сравнения вошли 15 пациентов с БП на стадиях 2,5 и 3, у которых был выявлен «сухой» гиперактивный мочевой пузырь (без ургентного недержания мочи). Больные данной группы получали лечение посредством тибиальной нейромодуляции по стандартной методике накожными электродами [7]. Средний возраст больных в группе сравнения составил 56,4±4,6 года. Обе группы исходно были сопоставимыми по полу, возрасту и когнитивному статусу (р=0,801).
На предварительном этапе и в процессе данного исследования все пациенты получали терапию по основному неврологическому заболеванию: препараты агонистов дофаминовых рецепторов, ингибиторов МАО, леводопы, амантадинов – в индивидуально подобранных схемах и дозах. Дозы противопаркинсонических препаратов в ходе исследования эффективности и безопасности тропия хлорида не менялись.
Дизайн исследования предполагал применение троспия хлорида в основной группе по индивидуально подобранной дозе (от 30 до 90 мг) на протяжении 52 нед. (рис.1). В каждой контрольной точке (недели 0 [визит 1], 4 [визит 2], 8 [визит 3], 52 [визит 4]) пациенты заполняли дневники мочеиспусканий (3 сут.), шкалу SF-Qualiveen (опросник по качеству жизни, связанного с нарушениями мочеиспускания, – короткую форму) [8], также проводилось измерение объема остаточной мочи при ультразвуковом исследовании (УЗИ). Оценка когнитивного статуса выполнялась на визитах 1, 2, 4 (на неделях 0, 4 и 52 соответственно) с помощью Международной монреальской шкалы оценки когнитивных функций (MoCA – Montreal Cognitive Assessment) [9]. Учет побочных эффектов проводился на визитах 2–4.
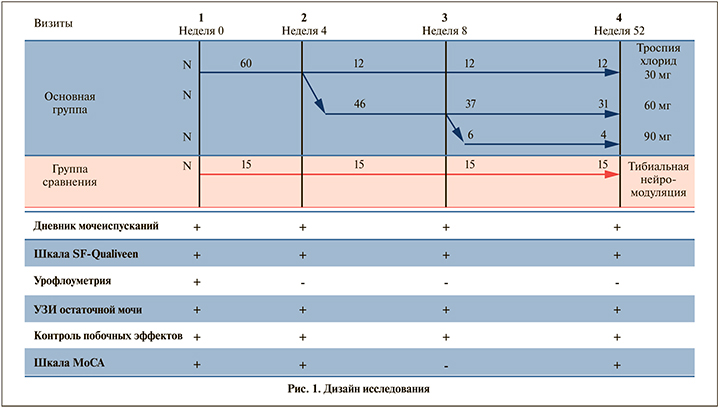
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализов. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel, 2016. Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (разработчик – IBM Corporation). Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро–Уилка. Для проверки различий между двумя сравниваемыми парными выборками нами применялся W-критерий Уилкоксона. При сравнении более двух зависимых совокупностей применен непараметрический критерий Фридмана. При сравнении нескольких выборок количественных данных использовался критерий Краскела–Уоллиса, являющийся непараметрической альтернативой однофакторного дисперсионного анализа.
Результаты. Из исследования выбыли 13 пациентов: шестеро стали недоступными для контакта (по 2 человека на визитах 2–4) по неизвестной причине, трое вышли из исследования из-за усиления запоров на визите 3, четверым потребовалось изменение схемы лечения основного заболевания после 8 нед. участия в исследовании (визит 3). В целом пациенты с БП показали высокую комплаентность к лечению троспия хлоридом: исследование закончили 47 пациентов (28 женщин и 19 мужчин) с БП и НГМП, что составило 78,3% больных основной группы.
Клиническая эффективность и удовлетворенность была достигнута у всех пациентов, закончивших исследование: 12 (25,5%) на дозе троспия хлорида 30 мг, 31 (66,0%) – на дозе 60 мг и 4 (8,5%) – на дозе 90 мг в сутки.
Эффективность троспия хлорида в отношении урологических симптомов и качества жизни. В ходе исследования продемонстрирована хорошая клиническая эффективность в обеих группах: к 52-й неделе наблюдалось снижение количества ежедневных мочеиспусканий, эпизодов ургентности и недержания мочи по сравнению с исходным уровнем. Обе группы продемонстрировали улучшение качества жизни, о чем свидетельствовало снижение баллов SF-Qualiveen по сравнению с исходными данными. Изменения по сравнению с исходным уровнем в контрольных точках представлены в таблице.
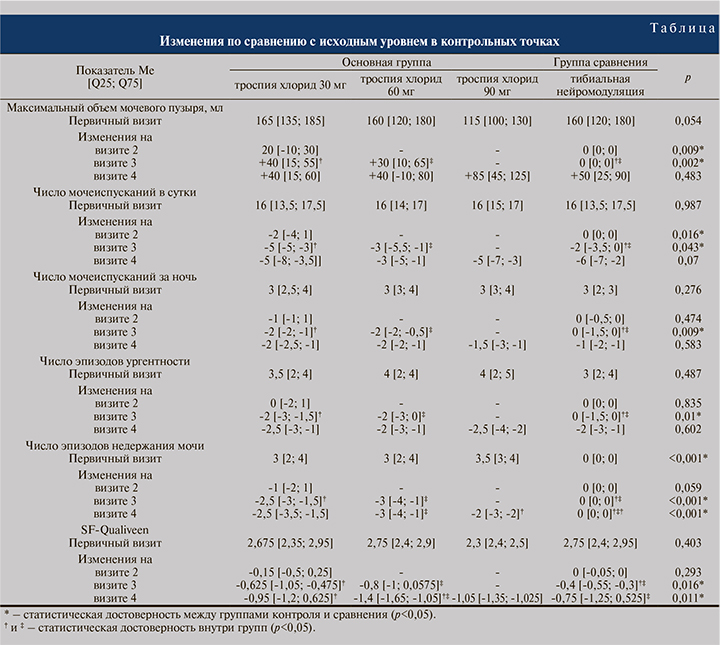
Безопасность. Нежелательные явления были зафиксированы только в группе, получавшей лекарственную терапию. Так, сухость во рту была разделена на «легкую» (облегчалась с помощью жидкости/леденцов), «умеренную» (сухость во рту и горле без затруднений при глотании твердой пищи/ воды) и «тяжелую» (сильная сухость во рту и горле, затрудненное глотание твердой пищи без воды) [10]. Жалобы на легкую сухость во рту отметили 2 (4,3% больных) пациента, 3 (6,4%) – на усиление запоров потребовалась отмена препарата, еще у 4 (8,5%) явления констипации были выражены в легкой или умеренной степени и не потребовали изменения терапии. Ультразвуковой мониторинг не выявил клинически значимого увеличения объема остаточной мочи (более 50 мл) ни у одного пациента. Побочных эффектов со стороны центральной нервной системы в виде головной боли, спутанности сознания, галлюцинаций ни в одной группе зарегистрировано не было.
Отдельно проведен анализ общего когнитивного статуса больных, включенных в исследование. Как было упомянуто выше, пациенты основной группы перед включением в исследование имели опыт терапии М-ХБ или β3-адреномиметиком. При оценке по шкале МоСА в начале исследования в подгруппе, которая ранее получала лечение М-ХБ (подгруппа 1), балл был достоверно (p<0,001) ниже, чем в других группах, получавших β3-адреномиметик (подгруппа 2) и не получавших предварительного лечения (подгруппа 3). При этом статистически значимых различий в балле МоСА между подгруппами 2 и 3 выявлено не было (р=0,571) (рис. 2). Таким образом, пациенты, ранее получавшие М-ХБ, имели общий когнитивный уровень хуже, чем остальные. Следует отметить, что после отмены оксибутинина и толтеродина и через 4 нед. терапии троспия хлоридом во всех трех подгруппах уже не было отмечено статистически значимых различий (p=0,284) в общем когнитивном статусе. Таким образом, наблюдаемая исходно разница между этими пациентами была нивелирована.
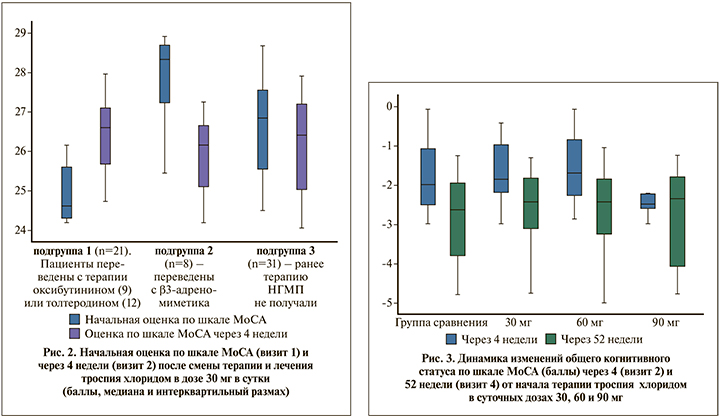
Когнитивный статус в течение всего последующего периода наблюдения остался без статистически значимых изменений у пациентов как основной, так и группы сравнения (р=0,569 и 0,983 для 4-й и 52-й недель соответственно), коррекции терапии не потребовалось (рис. 3).
Обсуждение. При БП пациенты получают комплексное лечение препаратами, направленными на коррекцию различных моторных и немоторных симптомов (дофаминергические, глутаматергические и холинергические средства, антидепрессанты, атипичные нейролептики и др.). Кроме того, с учетом пожилого возраста и высокой частоты коморбидности больных требуется назначение ряда препаратов для лечения сопутствовавших соматических заболеваний, что приводит к высокой частоте полипрагмазии у данных пациентов. В тех случаях, когда несколько лекарственных средств в печени метаболизируются одним ферментом, они вынужденно вступают в конкурентную связь за активных центр этого биокатализатора. Результатом может быть изменение действия препаратов.
Важной особенностью троспия хлорида является то, что он не трансформируется ферментами цитохрома Р-450: либо CYP2D6, либо CYP3A4 [11–13].
Цитохром Р-450 – общее название ферментов семейства P-450. Система цитохрома P-450 участвует в окислении многочисленных эндои экзогенных соединений. Ферменты этой группы играют важную роль в обмене желчных и ненасыщенных жирных кислот, стероидов, фенольных метаболитов, а также в нейтрализации лекарств [14]. Троспия хлорид лишь в малой степени может подвергаться метаболизму в печени. Вероятность его фармакокинетического взаимодействия с другими лекарственными средствами минимальна.
Еще одним преимуществом троспия хлорида является его химическая структура. Он, в отличие от других М-ХБ, представляет собой четвертичный амин, имеет положительный заряд, что делает его гидрофильным. Благодаря этому свойству лекарственное средство на 80% выводится с мочой, в отличие от третичных аминов, не проникает через гематоэнцефалический барьер и не должно приводить к развитию побочных эффектов со стороны центральной нервной системы [15, 16].
Статистический анализ показаний оценки по шкале МоСА до включения в исследование показал достоверную разницу между подгруппой пациентов, получавших третичные амины (оксибутинин и толтеродин), и больными, которые их предварительно не получали: у первых общий балл был ниже. Предположительно это связано с липофильностью указанных препаратов и их способностью оказывать влияние на когнитивную функцию [17–19]. Следует подчеркнуть, что после отмены оксибутинина и толтеродина ко второму визиту уже не было отмечено статистически достоверных различий в общем уровне когнитивных функций как в группах больных на различных дозах троспия хлорида, так и в группе сравнения (тибиальная нейромодуляция).
Таким образом, наше исследование показало отсутствие какого-либо отрицательного влияния троспия хлорида на когнитивные функции. Ни в группе пациентов, принимавших троспия хлорид, ни в когорте получающих тибиальную нейромодуляцию, мы не отметили значимого усугубления когнитивных нарушений. Полученные данные согласуются с данными международных исследований [20–22].
В нашем исследовании сухость во рту отметили только 2 (4,3% ) пациента. Это значительно реже, чем у больных с идиопатическим гиперактивным мочевым пузырем (46% пациентов) [23] при лечении М-ХБ. Мы связываем этот факт с тем, что в среднем 50% пациентов с БП жалуются на слюнотечение, а субклиническая сиалорея объективизируется по данным видеофлюороскопии у 90% [24]. И в данном аспекте ингибирование слюнных желез скорее можно считать положительным влиянием на общее состояние больного.
В целом исследование показало высокую приверженность больных (78,3%) БП к длительной терапии троспия хлоридом, хороший эффект в отношении урологических симптомов, благоприятный профиль безопасности и переносимости.
Заслуживает внимания скорость наступления положительных эффектов, выгодно отличающая лечение троспия холоридом от тибиальной нейромодуляции, которая также показала хороший профиль эффективности и безопасности. Так, в основной группе уже через 4 нед. от начала терапии троспия хлоридом зафиксировано статистически значимое уменьшение числа мочеиспусканий в течение дня и ночью, что сопровождалось статистически значимым увеличением максимального объема мочевого пузыря. На втором визите отмечено улучшение тех же показателей по сравнению с предыдущим измерением. В той же контрольной точке дополнительно зафиксированы статистически значимые положительные изменения со стороны уменьшения числа ургентных симптомов, что совпало с заметным улучшением качества жизни пациентов. Надо отметить, что на 4-м визите (52 нед. терапии) качество жизни больных стало еще лучше.
Троспия хлорид (спазмекс) является эффективным препаратом лечения НГМП вследствие БП. Лекарственное средство не вызывает ухудшения когнитивных функции при длительном применении (продолжительность наблюдения – 52 нед.). Троспия хлорид следует рассматривать как препарат выбора при назначении терапии урологических проявлений БП.



